题目内容
【题目】实验是学习化学的一个重要途径。
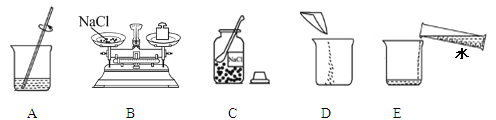
(1)根据下图回答问题。
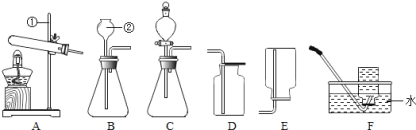
①仪器a的名称是 。
②实验室用高锰酸钾制取氧气时,所选用的发生装置是 (填字母序号,下同),收集装置是 或E。写出该反应的化学方程式 。
(2)实验室配制50g 5%的氯化钠溶液的操作示意图如图所示。其中玻璃棒的作用是 。该实验的正确操作顺序为 (填字母序号)。
(3)实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
①反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
②计算原过氧化氢溶液中溶质的质量分数.
【答案】(1)集气瓶 A C 2KMnO4 △K2MnO4 +MnO2 + O2↑
(2)加快溶解速度 CBDEA
(3)2.5g 3.4%
【解析】
试题分析:(1)用高锰酸钾制取氧气属固固加热型,应选A装置;氧气的密度比空气大,那么溶于水可用向上排空气法或排水法收集,选C或E装置;加热高锰酸钾分解制取氧气的同时,还生成了锰酸钾和二氧化锰,故反应的化学方程式是2KMnO4 △K2MnO4 +MnO2 + O2↑;
(2)配制溶液的一般步骤是:计算、称量、溶解。其中溶解时要用到玻璃棒,作用是加快固体的溶解速率;
(3)过氧化氢分解生成的是水和氧气,氧气会逸散到空气中,故反应结束后,过滤,洗涤并烘干滤渣,得到的滤渣是二氧化锰,二氧化锰是该反应的催化剂,其质量在化学反应前后不变,故质量为2.5g;
利用化学方程式,根据过氧化氢与氧气反应的质量比即可计算出过氧化氢的质量;
设过氧化氢的质量为X,
2H2O2![]() 2H2O+ O2↑
2H2O+ O2↑
68 32
X 1.6g
68/32 =x/1.6g
3.4g
过氧化氢溶液中溶质的质量分数=3.4g/100g ×100% =3.4%
答:略

 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】某实验小组利用废硫酸液制备K2SO4并研究CaSO42H2O加热分解的产物.
(一)K2SO4的制备
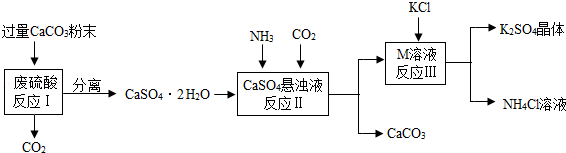
(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 .
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液
b.过量的BaCl2溶液
c.过量的Ba(NO3)2溶液
(二)研究CaSO42H2O加热分解的产物.
(5)分离所得的CaSO42H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 .
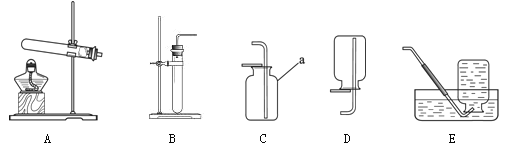
(6)为了测定CaSO42H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.
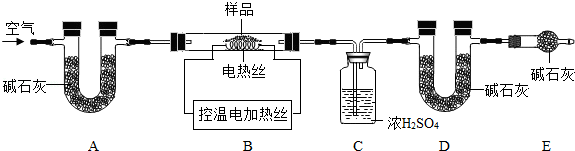
①实验前首先要 ,再装入样品.装置A的作用是 .
②已知CaSO42H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g
b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g
d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 (选填序号)两个数据组合也可求出x:y的值.
(7)CaSO42H2O受热会逐步失去结晶水.取纯净CaSO42H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 .
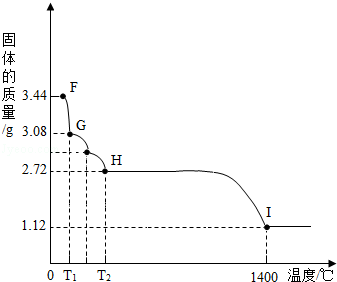
②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .