题目内容
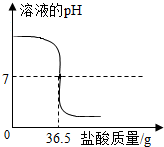 中和反应在工农业生产中应用广泛,现向40g 10%的氢氧化钠溶液中不断滴加盐酸,同时测定溶液pH的变化(曲线如图),请分析计算:
中和反应在工农业生产中应用广泛,现向40g 10%的氢氧化钠溶液中不断滴加盐酸,同时测定溶液pH的变化(曲线如图),请分析计算:(1)40g 10%的氢氧化钠溶液中含有
(2)所用盐酸的溶质质量分数(写出计算过程).
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算,溶液的酸碱性与pH值的关系
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据溶质质量=溶液质量×溶液的质量分数解答,氢氧化钠为碱,显碱性,其pH大于7,盐酸为酸,显酸性,其pH小于7,二者恰好完全反应时生成氯化钠和水,此时溶液pH为7;
(2)要求盐酸的溶质质量分数,需根据反应的化学方程式求出稀盐酸中溶质的质量.
(2)要求盐酸的溶质质量分数,需根据反应的化学方程式求出稀盐酸中溶质的质量.
解答:解:
(1)40g 10%的氢氧化钠溶液中含有氢氧化钠的质量为:40g×10%=4g;根据图象可以看出,开始时溶液呈碱性,pH大于7,向氢氧化钠溶液中加入盐酸,盐酸为酸,显酸性,其pH减小,当滴入36.5g盐酸时,溶液的pH为7;
(2)设稀盐酸中溶质的质量为x,
NaOH+HCl═NaCl+H2O
40 36.5
4g x
=
x=3.65g
所用盐酸的溶质质量分数=
×100%=10%
答案:所用盐酸的溶质质量分数为10%.
(1)40g 10%的氢氧化钠溶液中含有氢氧化钠的质量为:40g×10%=4g;根据图象可以看出,开始时溶液呈碱性,pH大于7,向氢氧化钠溶液中加入盐酸,盐酸为酸,显酸性,其pH减小,当滴入36.5g盐酸时,溶液的pH为7;
(2)设稀盐酸中溶质的质量为x,
NaOH+HCl═NaCl+H2O
40 36.5
4g x
| 40 |
| 36.5 |
| 4g |
| x |
x=3.65g
所用盐酸的溶质质量分数=
| 3.65g |
| 36.5g |
答案:所用盐酸的溶质质量分数为10%.
点评:本题考查了氢氧化钠和盐酸的中和反应及根据化学方程式的计算,完成此题,需根据已有的知识进行.

练习册系列答案
相关题目
下列各物质中,不能用金属与盐酸反应直接制取的是( )
| A、FeCl3 |
| B、MgCl2 |
| C、AlCl3 |
| D、FeCl2 |
 甲、乙、丙三种固体物质在水中的溶解度曲线如图所示.请回答:
甲、乙、丙三种固体物质在水中的溶解度曲线如图所示.请回答: 图中:A、B、C、D、E、F、G是初中化学常见的物质,其中A为单质,B为氧化物,C是大理石的主要成分,C和F属于不同类别的物质,D和E是配制农药波尔多液的两种原料.“-”表示两端的物质能发生反应,“→”表示一种物质可转化为另一种物质.
图中:A、B、C、D、E、F、G是初中化学常见的物质,其中A为单质,B为氧化物,C是大理石的主要成分,C和F属于不同类别的物质,D和E是配制农药波尔多液的两种原料.“-”表示两端的物质能发生反应,“→”表示一种物质可转化为另一种物质. 小明想探究空气中氧气的含量,做了如下实验,装置如图所示.先在集气瓶里加入少量水,再把剩余的容积用记号分成五等份.实验时点燃放在燃烧匙中的红磷,立即塞上橡皮塞.待燃烧完毕冷却后,打开导管上的止水夹.试回答下列问题:
小明想探究空气中氧气的含量,做了如下实验,装置如图所示.先在集气瓶里加入少量水,再把剩余的容积用记号分成五等份.实验时点燃放在燃烧匙中的红磷,立即塞上橡皮塞.待燃烧完毕冷却后,打开导管上的止水夹.试回答下列问题: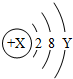 ,已知该粒子在化学反应中易得到2个电子形成稳定结构,X═
,已知该粒子在化学反应中易得到2个电子形成稳定结构,X═