题目内容
【题目】【2014山东省济南市】某化学研究小组的同学对金属铁、铝、铜进行系列研究.
(1)合金的应用是人类社会文明发展的象征.有下列三种合金:①铁合金;②铝合金;③铜合金,这三种合金被广泛应用的先后顺序按年代由远及近排列应是 (填序号).
(2)他们欲探究铁、铝、铜的金属活动性顺序,将铁丝、铝丝和铜丝分别放入三支分别盛有稀盐酸、稀硫酸、稀醋酸的试管中,观察反应现象,分析并得出结论.请指出该实验设计的不合理之处并说明理由 .
(2)该小组的同学还利用单质铜制取Cu(0H)2,其设计方案如图1:
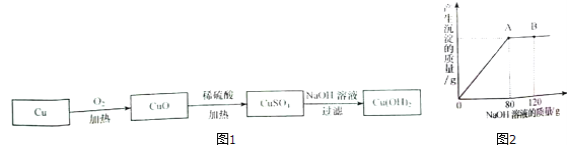
①铜在受热转化为CuO的过程中,观察到的现象是 .
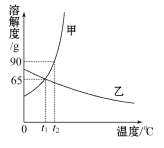
②取一定量的CuO放入盛有一定量稀硫酸的烧杯中,恰好完全反应.向烧杯中逐滴加入10%的NaOH溶液,产生沉淀的质量与所滴入NaOH溶液质量的关系曲线如图2所示,当滴入10%的NaOH溶液120g时(即B点),试通过计算,求,此时所得Cu(OH)2沉淀的质量(计算结果精确至0.1g).
【答案】(1)③①②;
(2)酸的种类不同,无法通过各金属与不同酸反应的剧烈成度来确定金属的活动性;
(3)①红色固体逐渐变成黑色;②9.8g
【解析】
试题分析:(1)活动性弱的金属不易发生化学反应,能以单质形式存在,并比较容易冶炼,故人类使用金属的顺序正好和金属的活动性相反,所以,人类开始使用这三种金属的先后排序为 Cu、Fe、Al;(2)将铁丝、铝丝和铜丝分别放入三支分别盛有稀盐酸、稀硫酸、稀醋酸的试管中.由于酸的种类不同,无法通过各金属与不同酸反应的剧烈成度来确定金属的活动性;(3)①铜受热生成黑色的氧化铜,因此观察到的现象是红色固体逐渐变成黑色;
②设所得Cu(OH)2沉淀的质量为x
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
80 98
80g×10% x
![]()
x=9.8g
答:所得Cu(OH)2沉淀的质量为9.8g.

 名校课堂系列答案
名校课堂系列答案