题目内容
【题目】铁矿石冶炼成铁是一个复杂的过程,把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
(1)一氧化碳还原氧化铁的化学方程式为。某兴趣小组在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。
(2)【提出问题】单质碳也具有还原性,为什么工业上不用焦炭作为还原剂直接还原铁矿石?焦炭还原四氧化三铁的化学方程式为。
(3)【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。【查阅资料】氢氧化钠溶液和澄清石灰水化学性质类似,能与二氧化碳反应,但反应无明显现象。
【进行实验】实验步骤及注意事项如下:
①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入下图装置A的试管中;另一份放入下图装置B的玻璃管中。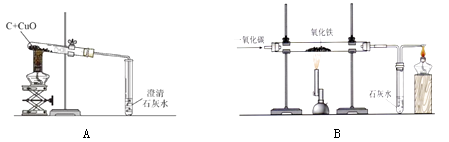
②装置A和B两组实验同时开始进行。在装置B的反应中,实验开始前应先(选填“通CO”或“加热”);实验结束后应继续通入CO直至冷却至室温,其原因是。
(4)【实验现象】当装置B的玻璃管中固体完全由 时(选填“红色变为黑色”或“黑色变为红色”),装置A的试管中仍有红色固体。
(5)【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。【交流与反思】经过查阅资料和讨论,该小组同学发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个原因:。
(6)【完善实验】联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2 , 将该气体通过下图的检验装置,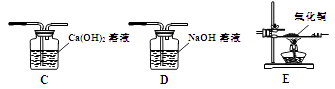
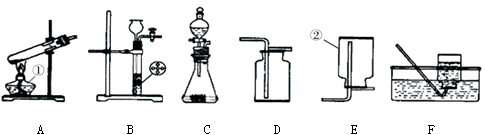
正确的连接顺序是:C → → → → C (选填字母,装置可重复使用)。
经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2 , 因此装置A的不足之处是。
【答案】
(1)3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
(2)2C+Fe3O4 ![]() 3Fe+2CO2↑
3Fe+2CO2↑
(3)通CO,防止高温下铁又被进入的空气氧化
(4)红色变为黑色
(5)焦炭是固体,不容易和生成的铁分离(焦炭中含有杂质会影响铁的纯度,用焦炭做还原剂还需另外提供热量来满足高温的反应条件等,合理即可)
(6)D,C,E,缺少尾气处理装置
【解析】一氧化碳还原氧化铁的化学方程式为:3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
【提出问题】焦炭具有还原性,还原四氧化三铁的化学方程式为:2C+Fe3O4 ![]() 3Fe+2CO2↑
3Fe+2CO2↑
【进行实验】②在装置B的反应中,实验开始前应先通CO,防止一氧化碳不纯时,在加热可能发生爆炸;实验结束后应继续通入CO直至冷却至室温,其原因:防止高温下铁又被进入的空气氧化
【实验现象】因为装置B中发生的反应时:3CO+Fe2O3 ![]() 2Fe+3CO2,故反应现象为:红色变为黑色
2Fe+3CO2,故反应现象为:红色变为黑色
【交流与反思】工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因:焦炭是固体,不容易和生成的铁分离(焦炭中含有杂质会影响铁的纯度,用焦炭做还原剂还需另外提供热量来满足高温的反应条件等,合理即可)
【完善实验】 要证明生成气体中含有CO和CO2,应先证明含有二氧化碳,通过澄清石灰水,再来证明是否含有一氧化碳,应根据一氧化碳的还原性,来检验其生成物二氧化碳,这就必须保证原一氧化碳气体中不含二氧化碳,故正确的连接顺序是:D→C→E,证实碳还原氧化铁所得的气体中确实含有CO和CO2,由于一氧化碳有毒,因此装置A的不足之处是:缺少尾气处理装置
故答案为:(1),3CO+Fe2O3 ![]() 2Fe+3CO2;(2)2C+Fe3O4
2Fe+3CO2;(2)2C+Fe3O4![]() 3Fe+2CO2↑;(3)通CO;防止高温下铁又被进入的空气氧化;(4)红色变为黑色(5)焦炭是固体,不容易和生成的铁分离(焦炭中含有杂质会影响铁的纯度,用焦炭做还原剂还需另外提供热量来满足高温的反应条件等,合理即可);(6)D;C;E;缺少尾气处理装置
3Fe+2CO2↑;(3)通CO;防止高温下铁又被进入的空气氧化;(4)红色变为黑色(5)焦炭是固体,不容易和生成的铁分离(焦炭中含有杂质会影响铁的纯度,用焦炭做还原剂还需另外提供热量来满足高温的反应条件等,合理即可);(6)D;C;E;缺少尾气处理装置
(1)工业炼铁:一氧化碳和三氧化二铁在高温下生成铁和二氧化碳
(2)根据碳的还原性,碳和四氧化三铁反应生成铁和二氧化碳
(3)一氧化碳具有可燃性,反应之前,应先通一氧化碳排尽空气,高温得到的铁易被氧化,在一氧化碳的保护下冷却
(4)有反应前后固体的颜色变化可解答
(5)根据澄清石灰水可检验二氧化碳\氢氧化钠可吸收二氧化碳,一氧化碳可还原氧化铜三者联系解答

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】深圳正在争创第六届全国文明城市,深圳人以实际行动积极参与“创文”。以下做法与创建文明城市不相符合的是
A.垃圾分类,变废为宝
B.节能减排, 绿色出行
C.资源管理,节约用水
D.焚烧落叶, 爱护环境