题目内容
呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂。下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中。【查阅资料】过氧化钠在常温下能与水反应生成NaOH和O2,与CO2反应产生Na2CO3(Na2CO3溶液呈碱性)和O2。
【设计实验】兴趣小组同学通过下图装置探究CO2与Na2O2的反应。实验过程如下:
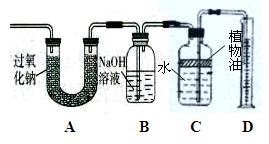
(1)测定过氧化钠样品中过氧化钠的纯度。
用上图装置通过测定产生的氧气的体积,从而测定过氧化钠样品中过氧化钠的纯度,则装置中B瓶的作用是 ,若没有B瓶,则测出的过氧化钠在样品中的质量分数 (填“偏大”、“偏小”或“不变”)。
(2)检验U型管中反应后剩余固体的成分。
A.[对固体的猜想]
猜想Ⅰ.全部是Na2CO3; 猜想Ⅱ. 。
B.【实验和推断】
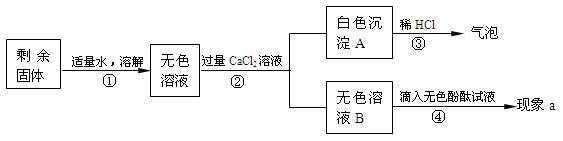
(1)步骤②所需要的玻璃仪器有:烧杯、玻璃棒和 ,玻璃棒在步骤①中的作用是 。
(2)步骤③说明白色固体A是 (填化学式),产生白色沉淀的化学方程式是 。
(3)若现象a没有明显变化,则猜想 成立。猜想Ⅱ成立,现象a是 。
【反思与拓展】①Na2O2与CO2反应的化学方程式是 。
②过氧化钠作潜水艇的供氧剂的优点是 (答一点)。
(1)除去未反应的CO2 偏大 (2)A猜想:是Na2CO3和Na2O2的混合物 B(1)漏斗 加速溶解 (2)Na2CO3 Na2CO3+CaCl2==CaCO3↓+2NaCl (3)Ⅰ 无色酚酞试液变红色 【反思与拓展】①2Na2O2+2CO2="2" Na2CO3+O2 ②在常温下反应(或能吸收人呼出的CO2等)解析:
略
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目











