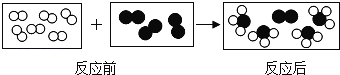
题目内容
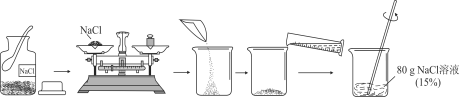
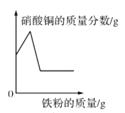
【题目】某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,操作流程如图所示。下列说法错误的是( )
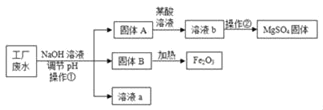
A. 固体A是Mg(OH)2
B. 操作①和②完全相同
C. 固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为H2O
D. 溶液a中一定含有的溶质是Na2SO4、NaCl、NaOH
【答案】B
【解析】
A、固体A最终对应硫酸镁,且是和氢氧化钠反应所得,所以为氢氧化镁Mg(OH)2,说法正确;
B、操作①是分离难溶性固体与液体,即过滤操作;操作②是从溶液中获得晶体,即蒸发,不相同,说法错误;
C、固体B即氢氧化铁,加热的产物是两种常见氧化物为氧化铁和水,则另一种氧化物的化学式为 H2O,说法正确;
D、溶液a除了可能含有NaOH外,还一定含有的溶质是氯化铁和氢氧化钠反应产物氯化钠以及硫酸镁和氢氧化钠反应生成的硫酸钠,对应的化学式为 NaCl、Na2SO4。说法正确。
故选:B。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】某学习小组在探究酸的化学性质时,做了如图所示的两个实验:
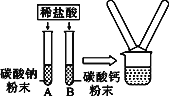
(1)分别向两支装有碳酸钠和碳酸钙粉末的试管中注入一定量的稀盐酸,两支试管内均观察到的现象是___________,固体粉末全部消失,最终形成无色溶液。
(2)实验结束后,同学们将A、B两支试管中的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊。过滤,对滤液中的溶质成分进行探究,请你一起参与。
(提出猜想)
猜想1:滤液中的溶质是氯化钠;
猜想2:滤液中的溶质是氯化钠和碳酸钠;
猜想3:滤液中的溶质是___________。
实验步骤 | 预计实验现象 | 预计结论 |
取少量的滤液于试管中,______ | ______ | 猜想______正确 |
(设计实验)请你选择一种猜想进行验证。
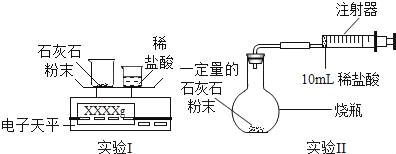
【题目】某校学习小组准备探究气体的测定和数据处理方法。
(提出问题)
如何利用石灰石(主要成分为CaCO3)与稀盐酸反应来测定生成CO2的质量和体积,并处理数据。
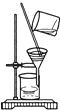
(实验设计)通过下列两个实验分别测定CO2的质量和体积:
(分析与表达)
(1)上述两个实验中,反应的化学方程式是_____。
(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中CaCO3完全反应的实验现象是_____。
(3)实验Ⅱ中,先连接好装置,再_____(填操作名称),然后装好药品,最后将10ml稀盐酸快速推入烧瓶中。若稀盐酸是缓慢推入的,则可能造成的后果是
_____。
(记录与处理)
(4)已知实验I反应前的总质量[m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是_____。
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
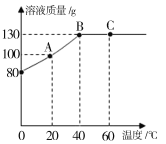
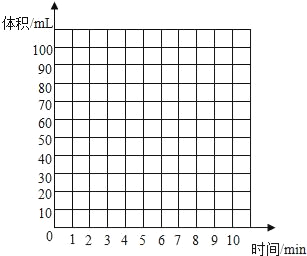
(5)实验Ⅱ的实验记录如下(表中数据在相同温度、相同压强条件下测定):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/ml | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
①根据以上实验过程和数据综合分析,最终生成CO2的体积是_____mL,理由是_____。
②根据你的认识,在坐标图中绘制出0~10min生成CO2体积随时间变化的曲线。
(反思与评价)
(6)经过分析,你认为实验I/span>的优点是_____,实验Ⅱ的优点是_____。