题目内容
中华文化源远流长,早在西汉时期《淮南万毕术》一书中就有“曾 青得铁则化为铜”的记载,这是我国现代“湿法炼铜”的先驱。某工厂利用此原理处理含硫酸铜的废液回收金属铜时,向1000kg的废液中加入足量的铁粉,得到金属铜64kg。
(1)计算废液中硫酸铜的质量分数是_____?(写出计算步骤)
(2)废旧金属很可能会造成水体污染和土壤污染;回收废旧金属的意义有利于金属资源的再利用,还有利于_______,(写一条即可)。
 阅读快车系列答案
阅读快车系列答案某化学兴趣小组的同学欲测定一份铜和锌混合物中锌的质量分数(铜和稀硫酸不反应),进行了如下实验。称量一定量铜和锌混合物放入烧杯中再加入100克质量分数为10%的稀硫酸,在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表:(假设匀速进行,烧杯质量25g)
反应时间(m) | 2 | 4 | 6 | 8 | 10 |
烧杯和剩余物的质量(g) | 134.97 | m | 134.91 | 134.90 | 134.90 |
请计算:
(1)表中“m”为_____g;
(2)该锌混合物中锌的质量分数?_____(写过程)
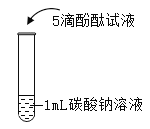
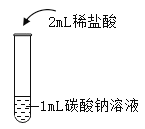
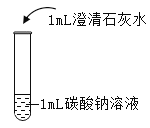
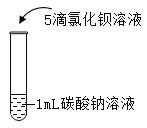
在课堂中通过实验探究了碳酸钠的性质,请回答下列问题。
实验一 | 实验二 | 实验三 | 实验四 | |
实验操作 |
|
|
|
|
实验现象 | 液体呈现红色 | 产生气泡 | _______ | ___________ |
实验结论 | ________ | _______ | 碳酸钠能与氢氧化钙反应。 | 碳酸钠能与氯化钡反应。 |
某实验小组的同学为了测定实验室中高锰酸钾样品的纯度,取20g该样品,依次加热该混合物,t1、t2、t3、t4时间后,称得剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 19.88 | 19.56 | 19.36 | 19.36 |
试计算:(1)加热__________时间后高锰酸钾已经完全反应。
(2)完全反应后产生氧气的质量为_________g。
(3)求该样品中高锰酸钾的质量分数_______。