题目内容
侯氏制碱法的核心反应原理如下:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3
某温度下,向溶质的质量分数为20%的氯化钠溶液47.25g中通入一定量氨气(NH3)和二氧化碳.充分反应后,将溶液中析出的碳酸氢钠晶体过滤,低温烘干,称量,质量为4.4g.计算需要通入氨气的质量.(已知:该温度下碳酸氢钠饱和溶液中,碳酸氢钠与水的质量比为1:9;且溶液中若存在其它溶质,不会对上述比值产生影响).
解:设需要氨气的质量为x
NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3
17 18 84
x

根据在常温下碳酸氢钠饱和溶液中,碳酸氢钠与水的质量比为1:9可得
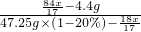 =
=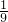
x=1.7g
答:需要氨气质量为1.7g
分析:根据化学方程式,用氨气的质量表示出生成的碳酸氢钠和消耗的水的质量,根据在常温下碳酸氢钠饱和溶液中,碳酸氢钠与水的质量比为1:9列出碳氢酸钠与水的质量关系.
点评:本题考查根据化学方程式的计算,关键是根据碳酸氢钠与水的质量关系列出比例式.
NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3
17 18 84
x


根据在常温下碳酸氢钠饱和溶液中,碳酸氢钠与水的质量比为1:9可得
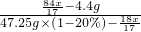 =
=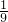
x=1.7g
答:需要氨气质量为1.7g
分析:根据化学方程式,用氨气的质量表示出生成的碳酸氢钠和消耗的水的质量,根据在常温下碳酸氢钠饱和溶液中,碳酸氢钠与水的质量比为1:9列出碳氢酸钠与水的质量关系.
点评:本题考查根据化学方程式的计算,关键是根据碳酸氢钠与水的质量关系列出比例式.

练习册系列答案
相关题目