题目内容
【题目】铁及其化合物是中学化学学习和研究的重要内容.
(1)如图是铁的原子结构示意图.下列说法不正确的是
A.铁元素属于金属元素
B.铁原子的质子数为26
C.铁在化学反应中易失去电子
D.铁是地壳中含量最高的金属元素
(2)活性铁粉常用作脱氧保鲜剂,原理是铁和氧气、水反应生成氢氧化铁,该反应的化学方程式为;单质铁可以和硫酸铁溶液反应生成硫酸亚铁,化学反应方程式为 .
(3)在实验中,进行铁丝在氧气中燃烧的实验时,瓶底放少量的水或砂子目的是; 在生活中为防止家中的菜刀生锈,可采取的方法是 .
(4)生物浸出技术在金属冶炼中应用广泛.嗜热细菌在酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分CuFeS2)产生硫酸盐,进而生产铜和绿矾(硫酸亚铁晶 体),主要流程如下: 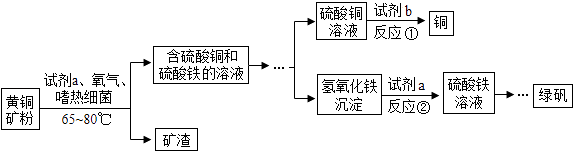
①若反应I的另一种产物最终也可制得绿矾,则试剂b为;若反应Ⅱ为中和反应,写出该反应的化学方程式 .
②现有100吨杂质质量分数为8%的黄铜矿(杂质不参与反应且不溶于水),经上述流程制得硫酸铁溶液,再向硫酸铁溶液中加入足量的铁粉,请计算能制得硫酸亚铁的质量 . 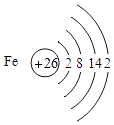
【答案】
(1)D
(2)4Fe+3O2+6H2O=4Fe(OH)3;Fe+Fe2 (SO4)3=3FeSO4
(3)防止生成的高温的熔融物炸裂集气瓶;保持菜刀的干燥和洁净
(4)铁粉;2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O;114t
【解析】解:(1)A.铁元素是金字旁,为金属元素; B.由图核内数字为26可知,铁原子的质子数为26;
C.铁原子最外层是2个电子,少于4个,且是不稳定结构,所以容易失去最外层的两个电子,所以铁在化学反应中易失去电子;
D.地壳中含量最高的金属元素是铝,而不是铁.(2)活性铁粉常用作脱氧保鲜剂,原理是铁和氧气、水反应生成氢氧化铁,该反应的化学方程式为 4Fe+3O2+6H2O=4Fe(OH)3;单质铁可以和硫酸铁溶液反应生成硫酸亚铁,化学反应方程式为 Fe+Fe2 (SO4)3=3FeSO4 . (3)在实验中,进行铁丝在氧气中燃烧的实验时,瓶底放少量的水或者砂子目的是 防止生成的高温的熔融物炸裂集气瓶;在生活中为防止家中的菜刀生锈,由于菜刀表面不能涂漆,也不适合抹油当然对于已经成品的菜刀也不能在加工为合金或者不锈钢,所以可采取的方法是 保持菜刀的干燥和洁净.(4)生物浸出技术在金属冶炼中应用广泛.嗜热细菌在酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分CuFeS2)产生硫酸盐,进而生产铜和绿矾(硫酸亚铁晶 体),主要流程如下:①由于过程中目的是为了得到绿矾,所以不能引入新的杂质,所以加入的试剂b为铁粉; 若反应Ⅱ为中和反应是氢氧化铁和硫酸反应生成硫酸铁和水.②现有100吨杂质质量分数为8%的黄铜矿(杂质不参与反应且不溶于水),经上述流程制得硫酸铁溶液,再向硫酸铁溶液中加入足量的铁粉,请计算能制得硫酸亚铁的质量.黄铜矿中CuFeS2的质量为100t×(1﹣8%)=92t.黄铜矿中铁元素的质量为92t× ![]() ×100%=28t因为黄铜矿中的铁全部转为硫酸铁,硫酸铁的质量为
×100%=28t因为黄铜矿中的铁全部转为硫酸铁,硫酸铁的质量为 ![]() =100t.
=100t.
设制备出的硫酸亚铁的质量为x.
Fe+Fe2(SO4)3= | 3FeSO4 |
400 | 456 |
100t | X |
![]() =
= ![]()
x=114t
故填:(1 ) D;(2)4Fe+3O2+6H2O=4Fe(OH)3;Fe+Fe2 (SO4)3=3FeSO4 . (3)防止生成的高温的熔融物炸裂集气瓶;保持菜刀的干燥和洁净.(4)①铁粉; 2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O.②114t
【考点精析】本题主要考查了金属材料的选择依据和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号才能正确解答此题.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案