题目内容
甲、乙、丙、丁四位同学用锌与稀硫酸反应,所得相关数据纪录如下(实验中的误差忽略不计)计算:(1)甲同学加入锌的质量x;(2)稀硫酸中溶质的质量分数.
| 甲 | 乙 | 丙 | 丁 | |
| 取用稀硫酸质量/g | 100 | 100 | 100 | 200 |
| 加入金属的质量/g | x | 1.25x | 2x | 2x |
| 生成氢气的质量/g | 0.4 | 0.5 | 0.6 | 0.8 |
解:(1)加入金属锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
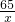 =
=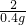
x=13g
(2)设稀硫酸中溶质质量为y,根据丙实验中的氢气的质量计算
Zn+H2SO4=ZnSO4+H2↑
98 2
y 0.6g
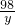 =
=
y=29.4g
100g硫酸溶液中溶质为29.4g,故硫酸溶液的溶质质量分数为 ×100%=29.4%
×100%=29.4%
故(1)甲同学加入锌的质量为13g;(2)稀硫酸中溶质的质量分数29.4%
分析:从表中数据前三次数据可知加的酸都是100g,加入的金属质量增大原来的四分之一产生的氢气就比比前一次增大0.1g,第三次比第二次加入的金属质量增大了四分之三若金属全反应生成的氢气应是第二次的三倍应为0.8g,可产生的氢气只比第二次增大了0.1g,说明甲乙两次酸都过量金属不足丙这次酸全反应金属不足,再看丁实验金属和丙用的一样多酸增加了一倍说明金属全反应酸过量,然后根据甲中数据和化学方程式Zn+H2SO4=ZnSO4+H2↑计算(1),根据丙中生成的氢气质量计算稀硫酸中溶质的质量,再结合溶质质量分数的公式解答(2)即可.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力,只要分析出反应中金属还是酸过量即可较快解答.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
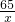 =
=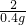
x=13g
(2)设稀硫酸中溶质质量为y,根据丙实验中的氢气的质量计算
Zn+H2SO4=ZnSO4+H2↑
98 2
y 0.6g
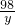 =
=
y=29.4g
100g硫酸溶液中溶质为29.4g,故硫酸溶液的溶质质量分数为
 ×100%=29.4%
×100%=29.4%故(1)甲同学加入锌的质量为13g;(2)稀硫酸中溶质的质量分数29.4%
分析:从表中数据前三次数据可知加的酸都是100g,加入的金属质量增大原来的四分之一产生的氢气就比比前一次增大0.1g,第三次比第二次加入的金属质量增大了四分之三若金属全反应生成的氢气应是第二次的三倍应为0.8g,可产生的氢气只比第二次增大了0.1g,说明甲乙两次酸都过量金属不足丙这次酸全反应金属不足,再看丁实验金属和丙用的一样多酸增加了一倍说明金属全反应酸过量,然后根据甲中数据和化学方程式Zn+H2SO4=ZnSO4+H2↑计算(1),根据丙中生成的氢气质量计算稀硫酸中溶质的质量,再结合溶质质量分数的公式解答(2)即可.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力,只要分析出反应中金属还是酸过量即可较快解答.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
关于化学方程式4P+5O2
2P2O5,四位同学表达了自己观点,其中正确的是( )
| ||
| A、甲同学说:磷、氧气、五氧化二磷三种物质的质量比为4:5:2 |
| B、乙同学说:这是一个分解反应 |
| C、丙同学说:生成物是一种混合物 |
| D、丁同学说:反应后固体的质量有所增加 |