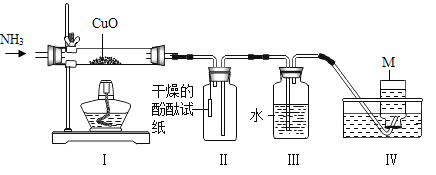
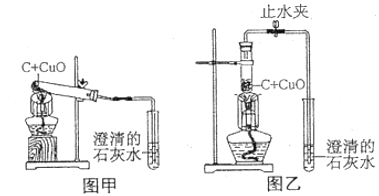
题目内容
【题目】A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示,请回答:

(1)要将t2℃时C的不饱和溶液变为饱和溶液,下列不可行的是_____。
A 加入溶质A
B 蒸发溶剂
C 升高温度
D 降低温度
(2)t2℃时,将A、B、C的饱和溶液都降温至t1℃,溶液中溶质的质量分数大小关系是_____。
(3)t2℃时,向100g水中加入63gA固体,发现全部溶解,一段时间后又有部分A晶体析出,你认为“全部溶解”的原因可能是_____。
【答案】D B>A>C A溶解时放出热使之溶解,之后恢复室温后又析出来了
【解析】
(1)要将t2℃时C的不饱和溶液变为饱和溶液,下列不可行的是:
A、加入溶质A,可以变为饱和溶液;
B、蒸发溶剂。可以变为饱和溶液;
C、升高温度,物质C的溶解度随着温度的升高而减小,升高温度可以变为饱和溶液;
D、降低温度,物质C的溶解度随着温度的降低而增大,降低温度不可以变为饱和溶液;
故选:D。
(2)t2℃时,物质溶解度关系为:A>B>C;将A、B、C的饱和溶液都降温至t1℃,A和B都有固体析出,但A析出的固体多,质量分数A<B,C没有固体析出,质量分数不变,则t1℃时溶液中溶质的质量分数大小关系是: B>A>C;
(3)t2℃时,A的溶解度为60g,且A的溶解度随着温度的升高而增大,向100g水中加入63gA固体,发现全部溶解,一段时间后又有部分A晶体析出,“全部溶解”的原因可能是:A溶解时放出热量,温度升高,溶解度增大,使之溶解,之后恢复室温后,温度降低,溶解度减小,又有固体析出。

【题目】小花同学从家乡的山上带回了一些石灰石样品,同学们利用这些石灰石样品做了如下实验:取样品20g放入烧杯中,将10g稀盐酸分5次加入,实验过程所得的数据如表所示(已知石灰石样品中的杂质不参与反应,也不溶于水)。根据实验数据计算:
实验次数 | 数加入稀盐酸的质量/g | 剩余固体的质量/g |
1 | 20 | 16 |
2 | 20 | 12 |
3 | 20 | 8 |
4 | 20 | 5 |
5 | 20 | 5 |
(1)盐酸在加到第_____次开始过量;
(2)石灰石样品中CaCO3的质量分数=_____;
(3)所用稀盐酸中溶质的质量分数_____(写出计算过程,结果精确到0.1%)。
【题目】下表是“部分酸、碱和盐的溶解性表(室温)”中的一部分,下列与“★”处有关的说法正确的是( )
阳离子 | 阴离子 | ||
… | … | NO | Cl- |
… | … | … | … |
Cu2+ | … | ★ | 溶 |
Ag+ | … | 溶 | 不 |
A. ★处对应物质的化学式是CuNO3 B. ★处对应物质属于盐
C. ★处应填“不” D. ★处对应物质的名称是氯化铜