题目内容
从C、H、O、N、S、P、Na、Fe、Ba等9种元素中选择恰当的元素,用离子符号、化学式或化学方程式按下列要求填空:(1)硫酸钠中的阴离子 ;
(2)能使木材、纸张变黑的酸 ;
(3)溶于水后显碱性的气体 ;
(4)一种暗红色的固体燃烧生成大量的白烟 .
(5)高炉炼铁(以赤铁矿为例)过程中还原成铁的主要反应原理 .
(6)有沉淀生成的中和反应 .
【答案】分析:(1)硫酸钠中的阴离子是指带负电荷的离子,为硫酸根离子;(2)浓硫酸具有很强的腐蚀性和脱水性来考虑;(3)显碱性的气体溶于水能形成碱性物质;(4)根据红磷燃烧生成白色的五氧化二磷固体进行分析;(5)根据高炉炼铁还原成铁的主要反应原理为一氧化碳还原氧化铁的反应进行解答;(6)根据中和反应为酸与碱反应生成盐的反应进行解答.
解答:解:(1)硫酸钠中的阴离子是指带负电荷的离子,为硫酸根离子,根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.但硫酸根离子是由多个原子组成的离子,整体带2个单元位的负电荷,表示为SO42-;
(2)浓硫酸具有很强的腐蚀性和脱水性,能把木材和纸张中的氢和氧按照水的比例脱去,剩下黑色的炭,硫酸的化学式为:H2SO4;故答案为:H2SO4;
(3)氨气溶于水形成氨水,氨水属于弱碱,所以氨气溶于水后显碱性,氨气的化学式为NH3;
(4)红磷是一种暗红色固体,燃烧后产生大量白烟,反应的化学方程式为:4P+5O2 2P2O5;
2P2O5;
(5)由题意,高炉炼铁(以赤铁矿为例)过程中还原成铁,则反应物为氧化铁与一氧化碳,生成物为铁与二氧化碳,反应条件为高温,故根据质量守恒定律,可以书写化学方程式,3CO+Fe2O3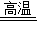 2Fe+3CO2;
2Fe+3CO2;
(6)由题意,氢氧化钡与硫酸的反应,符合中和反应的特征,且生成物中硫酸钡为沉淀,则化学方程式为Ba(OH)2+H2SO4=BaSO4↓+2H2O;
故答案为:(1)SO42-;(2)H2SO4;(3)NH3;(4)4P+5O2 2P2O5;(5)3CO+Fe2O3
2P2O5;(5)3CO+Fe2O3 2Fe+3CO2;(6)Ba(OH)2+H2SO4=BaSO4↓+2H2O;
2Fe+3CO2;(6)Ba(OH)2+H2SO4=BaSO4↓+2H2O;
点评:本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.
解答:解:(1)硫酸钠中的阴离子是指带负电荷的离子,为硫酸根离子,根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.但硫酸根离子是由多个原子组成的离子,整体带2个单元位的负电荷,表示为SO42-;
(2)浓硫酸具有很强的腐蚀性和脱水性,能把木材和纸张中的氢和氧按照水的比例脱去,剩下黑色的炭,硫酸的化学式为:H2SO4;故答案为:H2SO4;
(3)氨气溶于水形成氨水,氨水属于弱碱,所以氨气溶于水后显碱性,氨气的化学式为NH3;
(4)红磷是一种暗红色固体,燃烧后产生大量白烟,反应的化学方程式为:4P+5O2
 2P2O5;
2P2O5;(5)由题意,高炉炼铁(以赤铁矿为例)过程中还原成铁,则反应物为氧化铁与一氧化碳,生成物为铁与二氧化碳,反应条件为高温,故根据质量守恒定律,可以书写化学方程式,3CO+Fe2O3
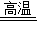 2Fe+3CO2;
2Fe+3CO2;(6)由题意,氢氧化钡与硫酸的反应,符合中和反应的特征,且生成物中硫酸钡为沉淀,则化学方程式为Ba(OH)2+H2SO4=BaSO4↓+2H2O;
故答案为:(1)SO42-;(2)H2SO4;(3)NH3;(4)4P+5O2
 2P2O5;(5)3CO+Fe2O3
2P2O5;(5)3CO+Fe2O3 2Fe+3CO2;(6)Ba(OH)2+H2SO4=BaSO4↓+2H2O;
2Fe+3CO2;(6)Ba(OH)2+H2SO4=BaSO4↓+2H2O;点评:本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.

练习册系列答案
相关题目