题目内容
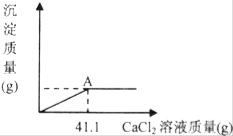
【题目】某化学课外活动兴趣小组的同学,对某化工产生产的纯碱样品(已知杂质只含氯化钠)的纯度产生了兴趣,设计实验并探究如下:①取一定质量的该样品,加55.65g水配成溶液;②向溶液中逐渐加入一定质量分数的CaCl2溶液(实验中产生的沉淀与加入CaCl2溶液的质量关系如图所示),当反应至A点时恰好完全反应;③过滤,测得所得滤液为100g14.35%的氯化钠溶液(实验过程中水的损失忽略不计)。试求:
(1)完全反应后,所得滤液中水的质量为 g。
(2)该纯碱样品中碳酸钠的质量分数为多少? 。(无计算过程不给分)
【答案】(1)85.65g (2)80%
【解析】
试题分析:
(1)完全反应后,所得滤液中水的质量为100g﹣100g×14.35%=85.65g;
(2)生成氯化钠的质量为:100g×14.35%=14.35g,
参加反应的氯化钙的质量为:41.1g﹣(85.65g﹣55.65g)=11.1g
设参加反应的碳酸钠质量为x,生成氯化钠的质量为y
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 117
11.1g x y
![]() =
=![]() =
=![]()
x=10.6
y=11.7g
所以![]() ×100%=80%。
×100%=80%。

练习册系列答案
相关题目