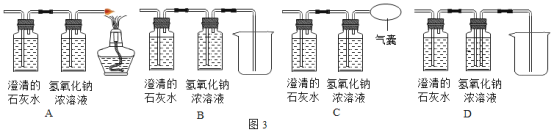
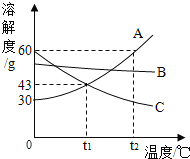
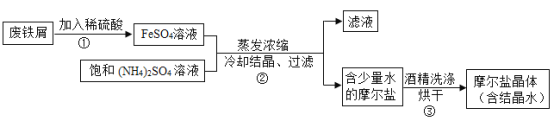
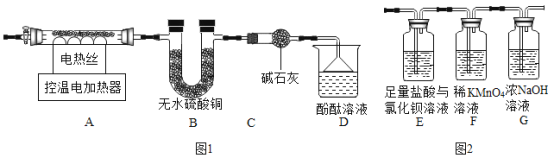
题目内容
【题目】在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水实验的装置图,回答下列问题:

(1)通电一段时间后电极上出现的现象是__________,用带火星的木条检验a管内的气体的现象是__________;b管内生成的气体的化学式为 _________。
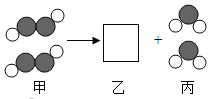
(2)根据图2该反应中发生分解的微粒名称是_________,不变的微粒名称是____。
(3)写出电解水的文字表达式___________。
(4)该实验证明了水是由__________ 组成的。
【答案】有气泡产生 带火星的木条复燃 H2 水分子 氢原子和氧原子 水![]() 氢气+氧气 氢元素和氧元素
氢气+氧气 氢元素和氧元素
【解析】
(1)通电一段时间后电极上出现的现象是:有气泡产生,故填:有气泡产生;
由图可知,a管内气体体积约为b管内气体体积的一半,则a管内气体应为氧气,b管内气体为氢气,氧气可使带火星的木条复燃,故填:带火星的木条复燃;H2;
(2)电解水的过程中,水分子破裂为氢原子和氧原子,氧原子重新组合成缺氧分子,氢原子重新组合成氢分子,发生分解的微粒为水分子,不变的微粒为氢原子和氧原子,故填:水分子;氢原子和氧原子;
(3)电解水生成氢气和氧气,文字表达式为:水![]() 氢气+氧气;故填:水
氢气+氧气;故填:水![]() 氢气+氧气;
氢气+氧气;
(4)电解水产物中含有氢元素和氧元素,因此水也是有氢元素和氧元素组成的,故填:氢元素和氧元素。

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目