题目内容
【题目】通过海水晾晒可得粗盐。粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示。
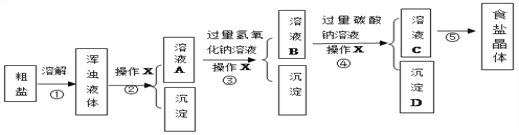
(1)操作X的名称是____________。
(2)第③步产生的主要沉淀B是_________(化学式)。其化学方程式是____________。
(3)蒸发时玻璃棒的作用是_________________,当______________时停止加热。
(4)该实验方案并不完善导致最后的产品混有较多杂质,你认为需要补充的实验和理由是____________________。
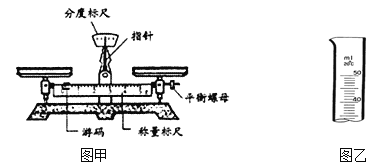
(5)实验室现在要配制50g 质量分数为8%的氯化钠溶液,托盘天平中称量溶质固体的质量,游码的示数是________g。量取水的体积(水的密度为1g/mL),图乙标出所需水的体积示数为__________________。
【答案】 过滤 Mg(OH)2 2NaOH+MgCl2==Mg(OH)2↓+2NaCl 搅拌,防止液滴飞溅 当蒸发皿中出现较多固体 在④和⑤之间增加滴入适量稀盐酸的操作,除去过量氢氧化钠和碳酸钠 4 ![]()
【解析】(1)把固体和液体分离的操作是过滤,故操作X的名称是过滤;(2)第③步产生的主要沉淀B是氢氧化钠和氯化镁反应生成的Mg(OH)2,其化学方程式是:2NaOH+MgCl2==Mg(OH)2↓+2NaCl;(3)蒸发时玻璃棒的作用是使液体均匀受热,防止液体飞溅,当出现较多固体时停止加热;(4)需要补充的实验:在④和⑤之间增加滴入适量稀盐酸,理由是:除去溶液中的氢氧化钠和碳酸钠;(5)托盘天平中称量溶质固体的质量为:50g×8%=4g,因此游码的示数是4g,量取水的体积为:(50g4g)÷1g/mL=46mL,图乙标出所需水的体积示数为![]() 。
。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】甲组同学往20克10%的氢氧化钠溶液样品中滴加10% 的盐酸(室温下)。
下图描述的是氢氧化钠与盐酸反应的微观实质。
(1)从分类角度:氢氧化钠属于。
A.氧化物
B.酸
C.碱
D.盐
(2)从宏观与微观角度:
请从微观的角度分析,甲、乙处应填入的化学符号依次是、。
请用离子符号表示酸碱中和反应的本质:。
判断在盐酸溶液中一定能大量共存的离子组是()
A、Na+、K+、CO32- B、Ag+、NO3-、SO42-
C、Cu2+、NO3-、OH- D、K+、NH4+、SO42-
(3)从能量角度,反应中溶液温度的变化 记录如表,据表数据分析:
加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
溶液温度上升(△t)/℃ | 5.6 | 12.1 | 18.5 | 15.2 | 13.5 |
①当加入盐酸体积为mL时,表明NaOH与HCl恰好完全反应。>此判断的依据是。
②当加入4mL盐酸时,烧杯中溶液仍然呈红色,该溶液中含有的溶质有酚酞和(写化学式)