题目内容
| A、根据甲、乙、丙三种物质的微观构成,分析构成物质的微粒; B、根据甲、丙两种物质的微观构成,分析物质的类别; C、根据化学反应的微观示意图中微粒的变化,分析分子、原子的变化; D、根据甲、乙、丙三种物质的微观构成,分析物质的类别. | |
| 解答: | 解:A、由甲、乙、丙三种物质的微观构成可知,甲、丙是由分子构成的、乙是由原子直接构成的.故A错误; B、由甲、丙两种物质的微观构成可知,甲是由汞、氧两种元素组成,属于氧化物,丙是由同种氧元素组成,属于单质.故B错误; C、由化学反应的微观示意图中微粒的变化可知,化学反应前后每种原子的种类及个数没有改变.故C正确; D、由甲、乙、丙三种物质的微观构成可知,甲属于化合物,乙、丙物质都属于单质.故D错误. 故选C. |
| 【实验原理】盐酸和氢氧化钠反应生成氯化钠和水,注意化学式的写法和配平; 【假设猜想】根据酸碱不能共存判断不合理的猜想; 【实验方案】(1)根据氯化铁和氢氧化钠反应产生氢氧化铁红褐色沉淀判断 (2)根据碳酸钠和盐酸反应能生成二氧化碳气体解答; 【推论与分析】 ①根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中; ②检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀 (3)根据氢氧化钠与盐酸反应的化学方程式进行计算 | |
| 解答: | 解:【实验原理】盐酸和氢氧化钠反应生成氯化钠和水,化学方程式为HCl+NaOH=NaCl+H2O 【假设猜想】盐酸和氢氧化钠反应生成氯化钠和水,酸或碱可能过量,但不能同时过量,因为酸碱不能共存,会继续反应,故猜想3不合理; 【实验方案】(1)氯化铁和氢氧化钠反应能生成氢氧化铁红褐色沉淀,因此溶液中滴加几滴氯化铁溶液,无明显变化,说明溶液中一定没有氢氧化钠. (2)溶液中有盐酸,滴加碳酸钠溶液后,碳酸钠会和盐酸反应生成二氧化碳气体,因此会看到产生气泡. 【推论与分析】 ①根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中,应用玻璃棒蘸取少量溶液涂到pH试纸上; ②检验一种物质时要排除其他物质的干扰,氯化钠也能与硝酸银反应生成白色沉淀,故不能证明溶液中一定存在盐酸;故猜想1成立 (3)①氢氧化钠的物质的量= ②解:设25g稀盐酸中有HCl的物质的量为 x HCl+NaOH=NaCl+H2O 1 1 x 0.05mol
X=0.05 (mol) HCl%= =7.3% 答:25g稀盐酸的溶质质量分数为7.3% 故答案为:【实验原理】HCl+NaOH=NaCl+H2O 【假设猜想】猜想3或3 【实验方案】NaOH 产生气泡 【推论与分析】 ①将pH试纸直接伸到待测溶液中,会污染试剂 ②NaCl与AgNO3反应也会生成白色沉淀,不能说明一定有HCl存在 猜想1或1 (3)①0.05mol②7.3% |

 名校课堂系列答案
名校课堂系列答案| A、根据“平衡膳食宝塔图”,可分析自己日常饮食结构的合理性 | B、根据“常见物质密度表”,可比较相同质量的水、酒精的体积大小 | C、根据“酸、碱和盐溶解性表”,可判断两种物质在某温度时的溶解度大小 | D、根据“等高线地形图”,可比较两地海拔的高低 |
| A、根据过滤实验的正确操作分析; B、根据蒸发实验的正确操作分析; C、根据滴管滴加液体的正确方法分析; D、根据取用固体药品的正确方法分析. | |
| 解答: | 解:A、过滤实验要用玻璃棒引流,漏斗的下端紧靠烧杯的内壁,故错误; B、蒸发实验用酒精灯加热,同时用玻璃棒不断搅拌滤液,使液体均匀受热,防止局部过热,造成液滴飞溅,故正确; C、胶头滴管伸入试管内或接触试管,会造成药品的污染,故错误; D、取用药品时,试剂瓶的瓶盖应倒放桌面上,防止污染瓶盖,图中操作错误. 故选B. |
| A、根据分子是由原子构成的进行分析判断. B、含有碳元素的化合物叫有机化合物,简称有机物. C、由同种元素形成的不同种单质互为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质. D、相对分子质量(式量)单位是“1”,不是“克”,常常省略不写. | |
| 解答: | 解:A、分子是由原子构成的,1个N4分子由4个氮原子构成的,故选项说法错误. B、N4是由一种元素组成的纯净物,是一种新型的单质,不属于有机物,故选项说法错误. C、N4和N2都是由氮元素形成的不同物质,都是单质,互为同素异形体,故选项说法正确. D、相对分子质量(式量)单位是“1”,不是“克”,常常省略不写,故选项说法错误. 故选C. |
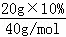 =0.05mol
=0.05mol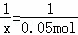
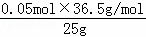 ×100%
×100%