题目内容
为测定某碳酸氢铵化肥中的含氮量,小滨在实验室里取用8.5 g该化肥样品与20 g NaOH溶液共热,恰好完全反应,测得残留物为26.8 g(提示:反应的化学方程式为NH4HCO3+2NaOH====Na2CO3+2H2O+NH3↑,生成的氨气全部逸出,其他成分不含氮,也不参加反应)。试求:
(1)生成氨气的质量。
(2)该化肥中氮元素的质量分数(计算结果精确到0.1%)。
(3)所用溶液的溶质质量分数。
(1)根据质量守恒定律,可求出生成氨气的质量为8.5 g+20 g-
26.8 g=1.7 g。
(2)设参加反应的碳酸氢铵的质量为x,参加反应的氢氧化钠的质量 为y
为y
NH4HCO3 + 2NaOH  ==== Na2CO3 + 2H2O + NH3↑
==== Na2CO3 + 2H2O + NH3↑
79 80 17
x y 1.7 g
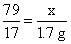 x=7.9 g
x=7.9 g
碳酸氢铵中含氮元素的质量为: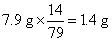
碳酸氢铵化肥中氮元素的质量分数为: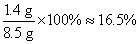
(3) 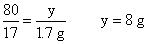
NaOH溶液的溶质质量分数为: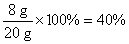
答案:(1)1.7 g (2)16.5% (3)40%

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目