题目内容
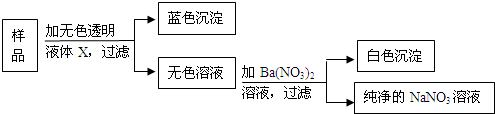
某包白色固体样品可能由NaCl,CuSO4,Na2SO4,NaOH,NaNO3中的一种或几种组成.试根据图示实验推测样品和所用液体X的成分(设每步反应都恰好完全进行)

(1)图示中蓝色沉淀是
(2)若样品中只有一种物质,则该物质一定是
(3)若样品是混合物,则无色液体X不可能是(填编号)
A.水 B.Na2SO4溶液 C.CuSO4溶液
D.NaNO3溶液 E.NaOH溶液 F.Na2SO4和NaNO3的混合溶液.

(1)图示中蓝色沉淀是
Cu(OH)2
Cu(OH)2
,白色沉淀是BaSO4
BaSO4
;(2)若样品中只有一种物质,则该物质一定是
CuSO4
CuSO4
,此时无色透明的液体X中一定含有水和NaOH
NaOH
;(3)若样品是混合物,则无色液体X不可能是(填编号)
C
C
.A.水 B.Na2SO4溶液 C.CuSO4溶液
D.NaNO3溶液 E.NaOH溶液 F.Na2SO4和NaNO3的混合溶液.
分析:(1)根据学过去的蓝色沉淀的记忆考虑;根据所给物质中提供的阴离子和钡离子结合产生的沉淀考虑;(2)由于X是无色液体,说明一定不是铜离子溶液,由于加入X后生成了蓝色沉淀,所以样品中必须含有铜离子化合物;X溶液必须含有氢氧根离子;(3)由于X是无色液体不可能带有颜色.
解答:解:(1)因为我们学过去的氢氧化铜是蓝色沉淀,所以蓝色沉淀是氢氧化铜,由于无色溶液加硝酸钡生成白色沉淀和硝酸钠,所以无色溶液属于钠盐,沉淀只能是与钡离子的沉淀,碳酸钡和硫酸钡都是沉淀,但是所给物质中只有硫酸根离子,所以白色沉淀是硫酸钡;
(2)由于X是无色液体,说明一定不是铜离子溶液,由于加入X后生成了蓝色沉淀,所以样品中必须含有铜离子化合物即一定含有硫酸铜;要生成氢氧化铜沉淀,X溶液必须含有氢氧根离子,又因为最后得到的是纯净的硝酸钠,所以阳离子是钠离子,所以X是氢氧化钠溶液;
(3)由于X是无色液体不可能带有颜色.即X不可能是硫酸铜溶液,因为硫酸铜溶液是蓝色的,X可以是水,只要混合物是硫酸铜和氢氧化钠的混合物,可以是硫酸钠,因为硫酸钠可以与加入的硝酸钡溶液反应生成硫酸钡沉淀和硝酸钠;可以是氢氧化钠,只要混合物中含有硫酸铜就行,可以与氢氧化钠反应,可以是硝酸钠,因为最后得到纯净的硝酸钠.
故答案为:(1)Cu(OH)2;BaSO4;(2)CuSO4;NaOH;(3)C.
(2)由于X是无色液体,说明一定不是铜离子溶液,由于加入X后生成了蓝色沉淀,所以样品中必须含有铜离子化合物即一定含有硫酸铜;要生成氢氧化铜沉淀,X溶液必须含有氢氧根离子,又因为最后得到的是纯净的硝酸钠,所以阳离子是钠离子,所以X是氢氧化钠溶液;
(3)由于X是无色液体不可能带有颜色.即X不可能是硫酸铜溶液,因为硫酸铜溶液是蓝色的,X可以是水,只要混合物是硫酸铜和氢氧化钠的混合物,可以是硫酸钠,因为硫酸钠可以与加入的硝酸钡溶液反应生成硫酸钡沉淀和硝酸钠;可以是氢氧化钠,只要混合物中含有硫酸铜就行,可以与氢氧化钠反应,可以是硝酸钠,因为最后得到纯净的硝酸钠.
故答案为:(1)Cu(OH)2;BaSO4;(2)CuSO4;NaOH;(3)C.
点评:解答本题的突破口是要知道蓝色沉淀是氢氧化铜,硫酸钡属于白色沉淀,硫酸铜溶液属于蓝色,氢氧化铜沉淀是铜离子和氢氧根离子结合生成的,必须含有铜离子和氢氧根离子才能生成氢氧化铜沉淀.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目
某包白色固体样品可能由NaCl, CuSO4, Na2SO4, NaOH, NaNO3中的一种或几种组成。试根据图示实验推测样品和所用液体X的成分(设每步反应都恰好完全进行)
|
![]()
![]()
|
![]()
|
|
![]()
![]() 加Ba(NO3)2溶液
加Ba(NO3)2溶液
|
![]()
![]() (1)图示中蓝色沉淀是_________,白色沉淀是_________
(1)图示中蓝色沉淀是_________,白色沉淀是_________
(2)若样品中只有一种物质,则该物质一定是_________,此时无色透明的液体X中一定含有水和_________。
(3)若样品是混合物,则无色液体X不可能是(填编号)_________
A、水 B、Na2SO4溶液 C、CuSO4溶液
D、NaNO3溶液 E、NaOH溶液 F、Na2SO4和NaNO3的混合溶液
(4)样品和液体X中都一定不含有_________物质。