题目内容
化学小组的同学为了测定某铜矿中碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]的质量分数,称取该铜矿样品30g,加入132.2g稀盐酸时恰好完全反应,共生成CO2气体4.4g。反应的化学方程式如下:
Cu2(OH)2CO3 +4HCl=2CuCl2+3H2O +CO2↑
请你计算:
⑴铜矿样品中碱式碳酸铜的质量是多少克?其质量分数是多少?
⑵反应后所得溶液中溶质质量分数是多少?
(假设铜矿中的杂质不与稀盐酸反应,也不溶于水。)
解:设铜矿中碱式碳酸铜的质量是为x,生成氯化铜的质量为y。
Cu2(OH)2CO3 +4HCl=2CuCl2 + 3H2O+ CO2↑
222 270 44
x y 4.4g (1分)
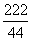 =
=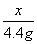 x =22.2g (1分)
x =22.2g (1分)
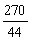 =
=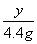 y =27g (1分)
y =27g (1分)
铜矿样品中碱式碳酸铜的质量分数为 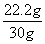 ×100%=74% (1分)
×100%=74% (1分)
反应后所得氯化铜溶液的质量为 22.2g+132.2g-4.4g=150g (1分)
反应后所得氯化铜溶液中溶质的质量分数为 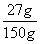 ×100%=18% (1分)
×100%=18% (1分)
答:铜矿样品中碱式碳酸铜的质量是22.2g ,其质量分数是74%。反应后所得氯化铜溶液中溶质的质量分数是18%。

 计算高手系列答案
计算高手系列答案小苏打(主要成分为NaHCO3)中常含有少量氯化钠。化学小组的同学为了测定小苏打中NaHCO3的质量分数,进行了以下实验:将样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所示。
| 物 质 | 样 品 | 消耗稀盐酸质量 | 反应后溶液质量 |
| 质量(g) | 9 | 75.4 | 80 |
(1)样品中的NaHCO3质量分数;
(2)所得溶液中溶质的质量分数。
实验室有一瓶保管不当的试剂(如右下图所示),其残缺的标签中只剩下“Na“和“l0%”字样。已知它是无色液体,是初中化学常用的试剂。
【提出问题】这瓶试剂可能是什么溶液呢?
【交流研讨】根据受损标签的情况 判断,这瓶试剂不可能是_____(填字母序号)。
判断,这瓶试剂不可能是_____(填字母序号)。
A. 酸 B. 碱 C. 盐
【查阅资料】
①初中化学常见的含钠化合物有NaCl、NaOH、Na2C03、NHC03。
②Na2C03和NaHC03溶液都呈碱性 。
。
③测定室温下(20℃)时,4种物质的溶解度的数据如下表所示。
表l物质的溶解度
| 物质 | NaCl | NaOH | Na2C03 | NaHC03 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中溶解度的数,据判断,这瓶试剂不可能是_______。
【猜想与实验】①可能是NaOH溶液;②可能是Na2C03溶液; ③可能是NaCl溶液。
(1 )小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是____。
)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是____。
(2)小强为了确定该溶液的成分,他又进行了如表2所示实验。
表2.实验记录
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 步骤一: 取样品于试管中,滴加 | 产生大量的气泡 | 猜想②正确 步骤二相关反应的化学方程 式是_______________ |
| 步骤二:把产生的气体通入澄清的石灰水中 | 澄清溶液变浑浊 |
【拓展与应用】(1)请你选择与小强不同的试剂来确定该溶液的成分,你选择_____溶液。
(2)小苏打(主要成分为NaHC03)中常含有少量氯化钠。化学小组的同学为了测定小苏打中NaHC03的质量分数,进行了以下实验:将样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所示。
| 物 质 1 样 品 | 消耗稀盐酸质量 | 反应后溶液质量 |
| 质量(g) 9 | 75.4 | 80 |
计算:反应后所得溶液的溶质质量分数。
| 物 质 | 样 品 | 消耗稀盐酸质量 | 反应后溶液质量 |
| 质量(g) | 9 | 75.4 | 80 |
(1)样品中的NaHCO3质量分数;
(2)所得溶液中溶质的质量分数.
