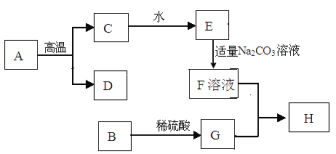
��Ŀ����
����Ŀ����ֿ����������ѹ������о��ij��ѧ��ȤС���ͬѧΪ����֤��֣���Ҫ����Fe��C��Si�����������ͼ���������̣���Щ��Ӧ�IJ��ַ�Ӧ�����������ʡ�ԣ���
�������Ϸ��ֳ����£����ʹ裨Si�����������ᷴӦ������������������Һ��Ӧ��Si+2NaOH+H2O�TNa2SiO2+2H2������

����������Ϣ���ش��������⣺
��1������A�ijɷ�Ϊ ����ҺB�еĽ���������Ϊ ��
��2��д���������з�����Ӧ�Ļ�ѧ����ʽ ���������Ӧ����Ϊ ��
��3���ڹ��˲���ʱ����������Һ���ǣ�Ӧ ��
��4���������з������ǻ��Ϸ�Ӧ������д���仯ѧ����ʽ ��
���𰸡���1��Si��C��Fe2+��
��2��3C+2Fe2O3![]() 4Fe+3CO2�����û���Ӧ��
4Fe+3CO2�����û���Ӧ��
��3���ҳ�ԭ���������¹��ˣ�
��4��4Fe(OH)2+O2+2H2O==4Fe(OH)3
��������
�����������1�����ʹ裨Si����C���������ᷴӦ��Fe+2HCl= FeCl2+H2��,����Һ�к���Fe2+
��2������ɫ��ĩE������������ɫ����D��̼������֮�䷴Ӧ�Ļ�ѧ����ʽ�ǣ�
3C + 2Fe2O3![]() 4Fe + 3CO2�� ��Ӧ�������û���Ӧ
4Fe + 3CO2�� ��Ӧ�������û���Ӧ
��3���ڹ��˲���ʱ����������Һ���ǣ�Ӧ�ҳ�ԭ���������¹���
��4���������з������ǻ��Ϸ�Ӧ����ѧ����ʽ�ǣ�4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3

����Ŀ��ͬѧ�Ƿ��ֽ�NaOH��Һ��ϡ�����Ϻ�û����������Ϊ��֤��NaOH����HCl�����кͷ�Ӧ�����������ʵ�飺
ʵ�鲽��[ | ���� | ���� |
ʵ��1.ȡ����NaOH��Һ���Թ��У������еμӼ�����ɫ��̪��Һ���� | ��Һ��_______ɫ | |
ʵ��2.��ʵ��1���Թ��м���������ϡ���ᣬ�� | _______________�� | NaOH��HCl�ܷ�Ӧ�� |
![]()
����������ۡ�д��NaOH��HCl��Ӧ�Ļ�ѧ����ʽ______________��
����˼�����ۡ�ͬѧ�Ƕ�ʵ��2��Ӧ��������Һ������Խ������ۣ�С��ͬѧ��Ϊ�ʼ��ԣ�С��ͬѧ��Ϊ�����ԣ�С��ͬѧ��ΪҲ���ܳ����ԣ����ͬѧ�Ƿ���С��ͬѧ��˵������������___������һ��ȷ��ʵ��2��Ӧ��������Һ������ԣ��������__________��
����Ŀ��С�ַ�������������м���һ�ְ�ɫ��ĩ����������ͷ���ɶ�ס����ܸ���Ȥ����̽�����ְ�ɫ��ĩ�ijɷ֡�ͨ�����г�����ز�Ʒ���е��飬�����������±���ʾ��������Ʒ����������ʹ�õİ�ɫ��ĩ������������Ʒ�е�һ�֡�
���� | �� | �� | �� |
��Ʒ | ʳ�ô��� | ʳ��С�մ� | ���ٷ��ͷ� |
�ɷ� | ̼���� | ̼������ | ̼�����ơ��л��� |
�÷� | ��ۼ�ˮ��ͳ����ţ����ͺ������ζ�������������������ͣ����ȼ����Ƴ���������ͷ�� | ������跢�ͣ�ֱ�Ӽ�������С�մ�ˮ���ͣ����뿾����ȼ����Ƴ����ɶ�ĸ�㡣 | ����뷢�ͷ۰��������ȣ�����������ˮ��ͣ�����һ��ʱ�䣬���������桢���Ƴ����ɶ�ĸ���ʳƷ�� |
��1������Ļ�ѧʽ�� ������ˮ��Һ��PH ��ͼ���е�������Ʒ������ʹ�ù����в���һ�����壬ʹ���ɵ���ͷ���ɶ�ף����������� ��
��2������һ:�ݻ�õ���Ϣ��С�����ʵ�鷽��һ����ʵ����̽�����ְ�ɫ��ĩ�ijɷ֡�
ʵ����� | ʵ������ | ʵ����� |
��ȡ������ɫ��ĩ���Թ��У���������������ˮ��ͣ�����һ��ʱ�䡣 | �����ܽ⣬�������������� | ����3�Ǵ���� |
��ȡ������ɫ��ĩ���Թ��У�������������ˮ���μ� �� �۽�����������ͨ������ʯ��ˮ�� | ����ɫ���ݲ����� �� | ����������ȷ��ʵ������йصĻ�ѧ����ʽ �� |
��3����ʦ��ʾС�֢ڢ۵ó��Ľ����в���֮����ԭ���� ������������������ʦ�İ���С�ָĽ�ʵ�鷽����ȷ�ϰ�ɫ��ĩ�ijɷ֡�
����������Ʒ�����ᷴӦ��������ıȽ�
��֪��������̼������4.2 g��̼����5.3 g��ȫ��Ӧ���ɵ����������ΪVml,��ͼ����ʾ��ͼI�Ƿ�Ӧװ�ã�ͼ��װ���ܲ�������Ӧ��������������

��1����֪������̼�����ڸ��Ͳ㣬ͼ��װ�����Ͳ�������� ��
��2�����������������ͼ�����ߣ��ɵ�������ͬ����Ķ�����̼���壬̼�����Ʊ�̼���Ƶ��ٶ� ���������
��3��С�ֲο���֪��ʵ�鷽����ͼI��ƿ�м�����5.3g�İ�ɫ��ĩ�����ʵ����ؾ����ԣ�����Һ©��������֪��ͬŨ�ȵ����ᣨ�������������������� �����ڡ�С�ڡ����ڣ�Vml��֤������������ȷ�ġ�
����Ŀ��ijС��ѧϰ��������̼��ȡ���о�������ʱ��̽���˶�����̼������ռ�������

���������ϡ�
ͨ��״���£�1 ���ˮԼ���ܽ�1 ���������̼��������ҺPH ԼΪ5.6��
��������⡿
������̼�ܲ�������ˮ���ռ���
��ʵ������������
��ͨ��״���£��ⶨ������̼��Һˮ������Һ����PH���ж϶�����̼��ˮ���ܽ�ȵ������
��1����װ���з�Ӧ�Ļ�ѧ����ʽ�� ��
��2��ʵ��ʱ�����Ƚ���װ���еĿ����ž���������ǣ��������ɼ� ������K1��K2��K3����ͬ���رյ��ɼ� ���������μ�ϡ�����������ž�������������ž��ķ����� ��
��3���ر�K1����K2��K3������װ�����ռ���ƿ����ʱ���رջ���K2 ��K3�������װ�á�Ȼ����pH�Ʋ���������ݣ�
���� | ��װ������Һ | ��װ������Һ |
pH | 6.50 | 5.60 |
������֪���ڱ��Ͷ�װ����ˮ���ܽ������̼����� ������ڡ�����С�ڡ��������ڡ��� ���Ͷ�װ������Һ���������
��4��ʵ���У���װ�õ������� ����û����װ�ã���������ҺpH �� ��
�������뷴˼��
��5����ʵ�����������Ϊ������̼ ����ܡ����ܡ�������ˮ���ռ����ܼ��ٶ�����̼��ˮ���ܽ�Ĵ�ʩ�� ����дһ�����ɣ�