题目内容
(8分)取只含有少量氯化钠杂质的粉末状纯碱样品11.4g于烧杯中,逐滴加入稀盐酸至不再产生气体为止,共消耗稀盐酸的质量为50g,反应后称得烧杯中溶液的质量为57g(假定反应产生的二氧化碳全部逸出,水蒸气挥发忽略不计)。请分析回答下列问题:
(1)题中涉及到的化学反应方程式为 。
(2)运用质量守恒定律,可以算出题中放出二氧化碳的质量为 g。
(3)计算反应后溶液中溶质的质量分数(写出详细的计算过程,数据精确到l%)。
(1)Na2CO3+2HCl= 2NaCl+H2O+CO2↑
(2)4.4
(3)解:设参加反应的NaCO3的质量为x,反应后生成NaCl的质量为y
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
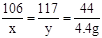 x=10.6g y=11.7g
x=10.6g y=11.7g
故反应后溶液中溶质的质量分数为:
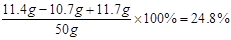
答:反应后溶液中溶质的质量分数为24.8%。
解析:略

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案(6分)KNO3和KCl在不同温度时的溶解度如下表所示。
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
|
溶解度/g |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
|
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
请回答下列问题:
(1)20℃时,KNO3的溶解度是 。
(2)30℃时,将KNO3和KCl固体各40g分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是 。将上述得到的不饱和溶液转化为该温度下的饱和溶液,可采用的一种方法是 。
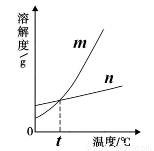
(3)依据上表中数据,已绘制出KNO3和KCl的溶解度曲线(如右图所示),图中能表示KNO3溶解度曲线的是 (填“m”或“n”)。
(4)从含有少量KCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用的方法是 。
(5)由表中数据分析可知,KNO3和KCl在某一温度t时具有相同的溶解度,则t的取值范围是 。