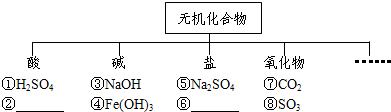
题目内容
(2009?南通)我们在学习碳酸钠和碳酸氢钠的时候,做过如图装置的实验.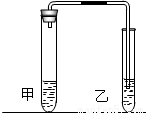
向盛有0.5g碳酸钠的试管里加入2mL盐酸,迅速用带导管的胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象.
用碳酸氢钠代替碳酸钠进行上述实验,观察现象.
(1)通过比较试管甲中的两次反应,填写下表:
| 碳酸钠+盐酸 | 碳酸氢钠+盐酸 | |
| 实验现象 | 反应迅速,生成大量气体. | 反应,生成气体更多. |
| 实验结论 | ||
(2)某同学对碳酸钠和碳酸氢钠与盐酸反应的快慢进一步研究.在老师的指导下,设计了下面的实验探究方案.
实验用品:相同型号的U型管2支、橡皮塞2个、5mL一次性注射器2支、气球个.
实验装置:如图.
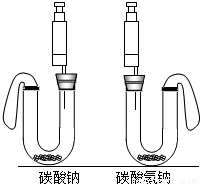
实验操作:在U型管中分别加入一定量碳酸钠和碳酸氢钠固体,在两支注射器中分别吸入同溶质质量分数、同体积的足量稀盐酸.将注射器插入橡皮塞中,然后同时迅速将盐酸分别注入U型管中.请对上述实验方案分析评价.
①若取用碳酸钠0.53g,为控制实验中产生气体的量相同,应取用碳酸氢钠g;
②该同学设计的实验方案是运用了研究的方法;
③实验过程中需要观察的现象是.
【答案】分析:(1)从实验现象来看,碳酸氢钠比碳酸钠的反应速度快,产生的二氧化碳多.
(2)为了比较反应速度的快慢,证明生成的二氧化碳一样多,用气球胀大的快慢作为依据,要产生相同质量的二氧化碳,所需碳酸钠和碳酸氢钠的质量可以据化学方程式求出.
解答:解:(1)碳酸氢钠比碳酸钠的反应速度快,产生的二氧化碳多,生成的二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,故本题答案为:
CO2+Ca(OH)2=CaCO3↓+H2O
(2)设0.53g碳酸钠能够生成二氧化碳的质量为x,则:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
0.53g x

解得 x=0.22g
设生成0.22g二氧化碳需要碳酸氢钠质量为y,则:
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
y 0.22g
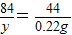
解得:y=0.42g
经计算可知,生成等质量的二氧化碳需碳酸氢钠的质量为0.42g,为了比较反应速度的快慢,证明生成的二氧化碳一样多,用气球胀大的快慢作为依据.
故本题答案为:①0.42 ②比较 ③气球胀大的快慢
点评:本题考查了影响化学反应速率的因素的探究,完成此题可以依据已有的知识,结合题干叙述的内容,来获得对我们解题有帮助的信息来完成解答.
(2)为了比较反应速度的快慢,证明生成的二氧化碳一样多,用气球胀大的快慢作为依据,要产生相同质量的二氧化碳,所需碳酸钠和碳酸氢钠的质量可以据化学方程式求出.
解答:解:(1)碳酸氢钠比碳酸钠的反应速度快,产生的二氧化碳多,生成的二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,故本题答案为:
| 碳酸钠+盐酸 | 碳酸氢钠+盐酸 | |
| 实验现象 | 反应迅速,产生大量的气体 | 反应更迅速,生成气体更多 |
| 实验结论 | 碳酸氢钠和盐酸反应比碳酸钠更快 | |
(2)设0.53g碳酸钠能够生成二氧化碳的质量为x,则:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
0.53g x

解得 x=0.22g
设生成0.22g二氧化碳需要碳酸氢钠质量为y,则:
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
y 0.22g
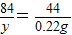
解得:y=0.42g
经计算可知,生成等质量的二氧化碳需碳酸氢钠的质量为0.42g,为了比较反应速度的快慢,证明生成的二氧化碳一样多,用气球胀大的快慢作为依据.
故本题答案为:①0.42 ②比较 ③气球胀大的快慢
点评:本题考查了影响化学反应速率的因素的探究,完成此题可以依据已有的知识,结合题干叙述的内容,来获得对我们解题有帮助的信息来完成解答.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 :A.实验前要先除去铁丝和银丝表面的氧化物,操作方法是
:A.实验前要先除去铁丝和银丝表面的氧化物,操作方法是