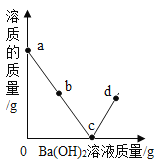
题目内容
【题目】某白色固体可能含有碳酸钙、硫酸钠、氢氧化钠、氯化钡、硫酸铜中的一种或几种。为确定该固体的成分,进行了如下实验。

①过滤操作中所需的仪器之一是_____(选填编号)。

②白色沉淀I是__________。
③请写出在无色溶液II中发生反应的化学方程式__________________。
④原白色固体中含有的物质是_____________________________。
【答案】 C CaCO3(碳酸钙) CO2 + 2NaOH![]() Na2CO3 + H2O 、Na2CO3 + BaCl2
Na2CO3 + H2O 、Na2CO3 + BaCl2![]() BaCO3
BaCO3![]() + 2NaCl 碳酸钙 氢氧化钠 氯化钡
+ 2NaCl 碳酸钙 氢氧化钠 氯化钡
【解析】本题主要考查盐的化学性质,碱的化学性质。加入足量的水过滤,分为白色沉淀1和无色溶液,一定没有硫酸铜(硫酸铜为蓝色),白色沉淀1可能是碳酸钙或硫酸钠与氯化钡反应生成的硫酸钡,但再加入盐酸后,白色沉淀溶解,所以一定是碳酸钙,无色溶液中加入二氧化碳后有白色沉淀,能入二氧化碳反应是氢氧化钠,但无现象,所以是与氢氧化钠反应生成的碳酸钠与氯化钡反应的碳酸钡,
滤操作中用的是漏斗,所以选C
根据分析白色沉淀I是CaCO3
根据分析,反应的化学方程式为:CO2 + 2NaOH==Na2CO3 + H2O 、
Na2CO3 + BaCl2==BaCO3![]() + 2NaCl
+ 2NaCl
根据分析原白色固体中含有的物质是:碳酸钙、 氢氧化钠、 氯化钡

【题目】“侯氏制碱法”的生产原理是:先将氨气通入饱和食盐水中,再将压缩的二氧化碳通入饱和的氨盐水,得到碳酸氢钠晶体,分离得到的碳酸氢钠晶体充分受热分解后即可制得纯碱。
NaCl和NH4Cl的溶解度表:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | |
溶解度 (g/100g水) | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | |
请根据提供的信息,回答问题:
①10℃时,NaCl的溶解度是______;
②如 图中,表示NH4Cl的溶解度曲线是_______(填“A”或“B”)。
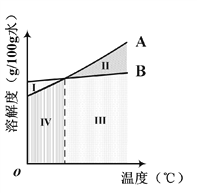
③常温20℃时,配制的饱和食盐水的质量分数为_____,将食盐水的温度提高,溶液中溶质的质量分数也将提高,而实际生产中往往在常温下进行,这样做的理由是____________________;
④若NaCl和NH4Cl溶液溶质质量分数相同,表示其溶NaCl和NH4Cl的溶解度曲线图液状态的点在右图中可能位于的区域是_______(选填I、II、III、IV);
⑤生产中通入氨气及二氧化碳,若要提高这些气体的溶解度,下列做法可行的是______(选填编号)。
A.增大压强 B.升高温度 C.增加水量