题目内容
镁、锌、铁的混合物50g与足量的硫酸铜溶液反应得到混合溶液,蒸干后得到218g固体(不含结晶水),则反应产生的铜质量为( )
| A.133g | B.112g | C.57.1g | D.49.2g |
Mg→MgSO4; Zn→ZnSO4; Fe→FeSO4,并且可知道,这个变化中,增加的质量是硫酸根的质量218g-50g=168g,在硫酸铜中,铜元素和硫酸根离子的质量比是:64:96,
设反应产生的铜质量为x,根据关系式A→ASO4→SO4→Cu,
64:96=x:168
x=112g,
故选B.
设反应产生的铜质量为x,根据关系式A→ASO4→SO4→Cu,
64:96=x:168
x=112g,
故选B.

练习册系列答案
相关题目
某铁的样品
5.6g投入足量的稀硫酸中,反应完全后生成0.21g的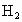 .则样品的成分可能是
.则样品的成分可能是
[
]|
A .生铁 |
B .纯铁 |
|
C .铁锌合金 |
D .生铁与镁的混合物 |
某铁的样品
5.6g投入足量的稀硫酸中,反应完全后生成0.21g的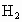 .则样品的成分可能是
.则样品的成分可能是
[
]|
A .生铁 |
B .纯铁 |
|
C .铁锌合金 |
D .生铁与镁的混合物 |