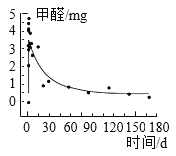
题目内容
【题目】利用下图进行粗盐中难溶性杂质去除,并配制100 g溶质质量分数为4%的氯化钠溶液的实验。
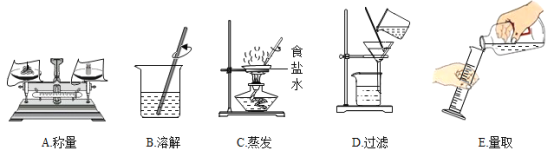
(1) 去除粗盐中难溶性杂质从而得到比较纯净的食盐,主要操作顺序是______ (填序号)。
(2) 配制100 g溶质质量分数为4%的氯化钠溶液操作顺序是计算、______ (填序号)。
(3) B中用玻璃棒不断搅拌的目的是______。
(4) 通过计算可知,托盘天平左盘中固体氯化钠的质量为______g
【答案】BDC AEB 加快溶解速率 4g
【解析】
(1)粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程。
(2)配制100g溶质质量为4%的氯化钠溶液,首先计算配制溶液所需氯化钠水的质量,再称量所需的氯化钠和量取水,最后进行溶解。
(3)B中用玻璃棒不断搅拌的目的是加快溶解速率。
(4)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量为4%的氯化钠溶液,需氯化钠的质量=100g×4%=4g。
故答案为:
(1)BDC;
(2)AEB;
(3)加快溶解速率;
(4)4。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】下列说法完全正确的是( )
A | 氖气的化学式—— 1个硅原子—— 1个钠离子--- | B | 决定元素种类——质子数 决定元素化学性质——最外层电子数 决定元素在周期表中的周期序数——电子层数 |
C | 铁——由分子构成 二氧化碳——由原子构成 硫酸铜——由离子构成 | D | 分子——化学变化中的最小粒子 原子——保持物质化学性质的最小粒子 离子——带电的原子或原子团 |
A. AB. BC. CD. D
【题目】用如图所示装置探究燃烧的条件。(提示,白磷的着火点为40oC)
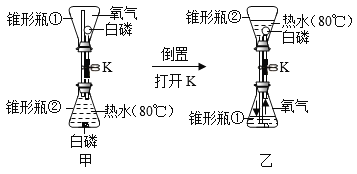
(1)通过下表进行现象分析:____________
可燃物 | 与氧气接触 | 温度达到着火点 | 是否燃烧 | |
甲① | ||||
甲② | ||||
乙①(例) | √ | ╳ | √ | ╳ |
乙② |
(2)通过以上分析,推出燃烧需要氧气的依据是____________。
【题目】实验小组同学按下图所示装置和表中所给试剂进行实验:
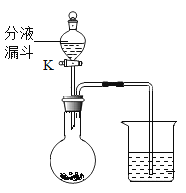
分液漏斗 | 圆底烧瓶 | 烧杯 |
过氧化氢溶液 | MnO2 | 80 °C水浸没白磷 |
稀盐酸 | 大理石 | 澄清石灰水 |
实验1:打开活塞K,使过氧化氢溶液从分液漏斗中流下后关闭K,观察到有气泡冒出,则圆底烧瓶中反应的化学方程式为______。还观察到烧杯中的白磷燃烧,说明燃烧需要的一个条件是 ______。
实验2:打开活塞K,使稀盐酸从分液漏斗中流下后关闭K,烧杯中的现象是______,则烧杯内发生的反应方程式为______。