题目内容
【题目】在氯化钙和氯化钠的混合物中加入一定量的水,全部溶解得到50克混合溶液,向该溶液中逐滴加入一定溶质质量分数的碳酸钠溶液,生成沉淀与加入碳酸钠溶液的质量关系如图所示.计算: 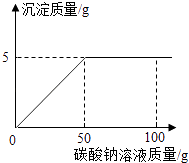
(1)所加碳酸钠溶液的溶质质量分数.
(2)若恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是多少?
【答案】
(1)解:由图象可知,CaCO3的质量为5g,
设原混合物中碳酸钠的质量为x,生成氯化钠的质量为y,参加反应的氯化钙的质量为z.
Na2CO3+ | CaCl2═ | CaCO3↓+ | 2NaCl |
106 | 111 | 100 | 117 |
x | z | 5g | y |
![]() =
= ![]() =
= ![]() =
= ![]()
x=5.3g,y=5.85g,z=5.55g
所加碳酸钠溶液的溶质质量分数为 ![]() ×100%=10.6%
×100%=10.6%
(2)解:原固体混合物的质量是w
所以 ![]() ×100%=10%
×100%=10%
w=9.2g
【解析】(1)根据沉淀的质量和方程式计算碳酸钠和氯化钠的质量,进一步计算碳酸钠溶液的溶质质量分数.(2)根据恰好完全反应时溶液中溶质的质量分数公式分析.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目