题目内容
Na2CO3和NaCl混合物11g加入到盛有50 g稀盐酸的烧杯中,恰好完全反应,称得烧杯中的溶液质量为56.6g.请计算:
(1)完全反应后生成二氧化碳的质量为 g.
(2)反应后将溶液蒸干,可得NaCl的质量 g.
(1)完全反应后生成二氧化碳的质量为
(2)反应后将溶液蒸干,可得NaCl的质量
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:固体混合物中碳酸钠与盐酸反应放出气体二氧化碳,根据质量守恒定律计算出二氧化碳的质量,然后利用化学方程式计算混合固体中碳酸钠的质量和生成的氯化钠的质量,
解答:解:(1)反应生成二氧化碳的质量=11g+50g-56.6g=4.4g;故填:4.4;
(2)设碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
=
,
=
x=10.6g,y=11.7g
反应后将溶液蒸干,可得NaCl的质量:11g-10.6g+11.7g=12.1g;
故填:12.1.
(2)设碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
| 117 |
| y |
| 44 |
| 4.4g |
x=10.6g,y=11.7g
反应后将溶液蒸干,可得NaCl的质量:11g-10.6g+11.7g=12.1g;
故填:12.1.
点评:根据质量守恒定律,反应后所得溶液的质量=固体混合物的质量+稀盐酸的质量-生成二氧化碳气体的质量.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
要除去NaOH中混有的少量Na2CO3杂质,可以加入的试剂是( )
| A、稀盐酸 |
| B、石灰水 |
| C、CaCl2溶液 |
| D、通入CO2气体 |
下列叙述中,错误的是( )
| A、硬铝可用于制造飞机 |
| B、锌常用于电镀,制造干电池 |
| C、铝可用于制造电线 |
| D、碳素钢的主要成分是碳 |
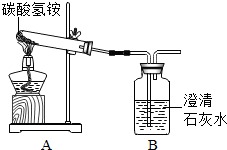 炎炎夏日,查理看到花园植物叶色发黄,于是给植物施用了碳酸氢铵肥料.他将肥料埋入靠近植物根部的土壤时,不小心将部分肥料洒落在干燥地面.可是,很快他发现洒落在地面的肥料消失了.针对洒落地面肥料消失的原因查理开展如下探究活动,请你参与并完成下列问题.【分析猜想】之一:被花园植物吸收了; 之二:被土壤溶液溶解了;
炎炎夏日,查理看到花园植物叶色发黄,于是给植物施用了碳酸氢铵肥料.他将肥料埋入靠近植物根部的土壤时,不小心将部分肥料洒落在干燥地面.可是,很快他发现洒落在地面的肥料消失了.针对洒落地面肥料消失的原因查理开展如下探究活动,请你参与并完成下列问题.【分析猜想】之一:被花园植物吸收了; 之二:被土壤溶液溶解了;