题目内容
向试管中加入固体或液体的操作方法错误的是
- A.
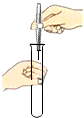
将铁钉放入试管 - B.

将二氧化锰粉末放入试管内 - C.
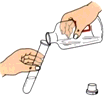
向试管内倾倒少量稀盐酸 - D.
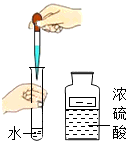
向试管内滴加数滴浓硫酸
AD
分析:A、根据取用固体药品的注意事项分析;
B、根据取用固体粉末状药品的注意事项分析;
C、倾倒液体时,注意瓶口、标签的位置,瓶塞的放置等;
D、根据用滴管滴加液体的注意事项分析.
解答:A、将铁钉放入试管中:将试管横放,然后将铁钉置于试管口,再缓缓是试管直立,使铁钉缓缓滑至试管底部.故本选项错误;
B、将二氧化锰粉末放入试管中:应用药匙或纸槽.操作时,试管横放,将药品平送入试管底部,试管竖直起来,手指轻弹药匙柄或纸槽,使药品全部落入试管底.故本选项正确;
C、向试管内倾倒少量稀盐酸时,瓶塞应该倒置于桌面上,标签向着手心,瓶口与试管口紧挨,故本选项正确;
D、向试管中滴加数滴硫酸时,滴入试剂时,滴管应保持垂直悬于容器口上方滴加.故本选项错误;
故选AD.
点评:化学是一门以实验为基础的学科,而基本的操作又是实验考查的重点之一,要理解掌握操作过程和注意事项.
分析:A、根据取用固体药品的注意事项分析;
B、根据取用固体粉末状药品的注意事项分析;
C、倾倒液体时,注意瓶口、标签的位置,瓶塞的放置等;
D、根据用滴管滴加液体的注意事项分析.
解答:A、将铁钉放入试管中:将试管横放,然后将铁钉置于试管口,再缓缓是试管直立,使铁钉缓缓滑至试管底部.故本选项错误;
B、将二氧化锰粉末放入试管中:应用药匙或纸槽.操作时,试管横放,将药品平送入试管底部,试管竖直起来,手指轻弹药匙柄或纸槽,使药品全部落入试管底.故本选项正确;
C、向试管内倾倒少量稀盐酸时,瓶塞应该倒置于桌面上,标签向着手心,瓶口与试管口紧挨,故本选项正确;
D、向试管中滴加数滴硫酸时,滴入试剂时,滴管应保持垂直悬于容器口上方滴加.故本选项错误;
故选AD.
点评:化学是一门以实验为基础的学科,而基本的操作又是实验考查的重点之一,要理解掌握操作过程和注意事项.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
 (2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.
(2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究. (2012?高安市二模)某兴趣小组走进实验室看到了一个不和谐的“音符”(如图).
(2012?高安市二模)某兴趣小组走进实验室看到了一个不和谐的“音符”(如图).