题目内容
某合金的主要成分有锌、铜、碳等物质.为测定合金的某些含量做如下实验:向50.3g合金粉末中逐次滴加等质量的质量分数为20.0%的硫酸铜溶液(已知碳不参与反应),充分反应后,得到如下部分数据和图象.


计算反应后:
(1)粉末减轻的质量.
(2)加入320.0g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比.
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0g).
(1)粉末减轻的质量.
(2)加入320.0g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比.
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0g).
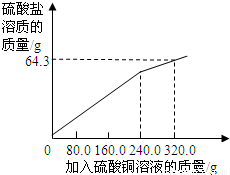
(1)根据图象结合表格提供的数据可以看出加入硫酸铜的质量为240g粉末质量不再改变,每加入80g硫酸铜粉末减轻0.1g,所以粉末共减轻0.1g ×3=0.3g;
(2)铜元素与硫酸根离子的质量比=(80.0 g ×20.0% ×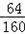 ):(320.0 g×20.0%×
):(320.0 g×20.0%×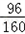 )=1:6;
)=1:6;
(3)反应后粉末中铜元素的质量分数=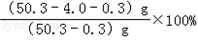 =92.0%.
=92.0%.
答:粉末减轻的质量为0.3 g,铜元素与硫酸根离子的质量比为1:6,充分反应后,剩余粉末中铜元素的质量分数为92.0%.
(2)铜元素与硫酸根离子的质量比=(80.0 g ×20.0% ×
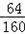 ):(320.0 g×20.0%×
):(320.0 g×20.0%×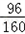 )=1:6;
)=1:6;(3)反应后粉末中铜元素的质量分数=
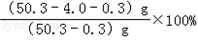 =92.0%.
=92.0%.答:粉末减轻的质量为0.3 g,铜元素与硫酸根离子的质量比为1:6,充分反应后,剩余粉末中铜元素的质量分数为92.0%.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某合金的主要成分有锌、铜、碳等物质.为测定合金的某些含量做如下实验:向50.3g合金粉末中逐次滴加等质量的质量分数为20.0%的硫酸铜溶液(已知碳不参与反应),充分反应后,得到如下部分数据和图象.

计算反应后:
(1)粉末减轻的质量.
(2)加入320.0g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比.
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0g).
| 次数 | 第1次 | 第2次 |
| 硫酸铜溶液的质量/g | 80.0 | 80.0 |
| 粉末的质量/g | 50.2 | 50.1 |

计算反应后:
(1)粉末减轻的质量.
(2)加入320.0g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比.
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0g).
某合金的主要成分有锌、铜、碳等物质.为测定合金的某些含量做如下实验:向50.3g合金粉末中逐次滴加等质量的质量分数为20.0%的硫酸铜溶液(已知碳不参与反应),充分反应后,得到如下部分数据和图象.
| 次数 | 第1次 | 第2次 |
| 硫酸铜溶液的质量/g | 80.0 | 80.0 |
| 粉末的质量/g | 50.2 | 50.1 |
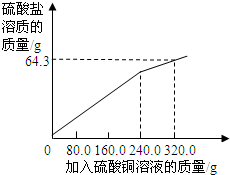
计算反应后:
(1)粉末减轻的质量.
(2)加入320.0g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比.
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0g).
(2009?宣武区一模)某合金的主要成分有锌、铜、碳等物质.为测定合金的某些含量做如下实验:向50.3g合金粉末中逐次滴加等质量的质量分数为20.0%的硫酸铜溶液(已知碳不参与反应),充分反应后,得到如下部分数据和图象.
计算反应后:
(1)粉末减轻的质量.
(2)加入320.0g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比.
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0g).
| 次数 | 第1次 | 第2次 |
| 硫酸铜溶液的质量/g | 80.0 | 80.0 |
| 粉末的质量/g | 50.2 | 50.1 |

计算反应后:
(1)粉末减轻的质量.
(2)加入320.0g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比.
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0g).