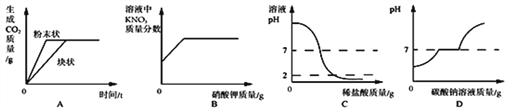
题目内容
【题目】工业烟气脱硫是将烟气中含有的二氧化硫除去。采用“双碱法”脱硫的工业流程如下。下列说法错误的是
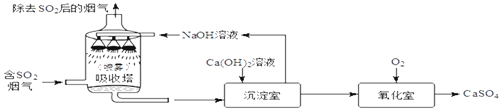
A. 流程中有三种元素化合价发生改变
B. 理论上如果生成13.6gCaSO4,那么实际吸收的SO2质量应该是6.4g
C. NaOH溶液喷成雾状的目的是增大接触面积,充分吸收SO2
D. 吸收塔中发生反应的基本类型是复分解反应
【答案】AD
【解析】A.单质中元素的化合价为零,化合物中元素的化合价代数和为零。二氧化硫中硫元素显+4价,硫酸钙中硫元素显+6价;氧气中氧的化合价为零,化合物中氧的化合价为-2价;流程中只有氧、硫两种元素化合价发生改变,错误;B. 据质量守恒定律可知反应前后元素的种类、质量不变,生成CaSO4与吸收的SO2中,硫元素的质量相等;要生成13.6gCaSO4,设实际吸收的质量应该是x;CaSO4 ~ SO2
136 64
13.6g x 136/13.6g=64/x x=6.4g 正确;C. NaOH溶液喷成雾状的目的是增大氢氧化钠和二氧化硫的接触面积, 使SO2吸收更彻底、更充分,正确;D.两种化合物相互结合生成两种新的化合物的反应,叫复分解反应,吸收塔中二氧化硫和氢氧化钠发生反应,生成亚硫酸钠和水,化学方程式为2NaOH+SO2===Na2SO3+H2O,不是复分解反应;错误。故选AD。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目