��Ŀ����
����Ŀ��ij��������ȡ����ͭ����������;����
Aͭ��ϡ���ᷴӦ����Ӧ�Ļ�ѧ����ʽΪ��3Cu+8HNO3��ϡ����3Cu��NO3��2+2NO��+4H2O�����ɵ�һ�������ڿ����к����ױ������ɶ���������
Bͭ��Ũ���ᷴӦ����Ӧ�Ļ�ѧ����ʽΪ��Cu+4HNO3��Ũ����Cu��NO3��2+2NO2��+2H2O��
��1��һ�������������������Ǵ�����Ⱦ���������Ҫ�����ܼ����ŷţ����жϣ���Ҫ�Ƶõ�����������ͭ����������;���Ϻã�____������____��
��2����ȡ6.4gͭ���뵽50g��һ������������ijϡ�����У�ǡ����ȫ��Ӧ��
�������Ƶõ�����ͭ��������_____��
��ԭϡ���������ʵ�����������_____��
���𰸡�A;���� ��ȡ����������ͭA������ʡԭ�ϣ�������Ⱦ���� 18.8g 33.6%
��������
��1������һ�������Ͷ������������ж����壬���ֱ���ý���ͭ�����ᷴӦ����ȡ����ͭ���������ѡ��
��2������ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽCu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O��ͭ�������ɼ������ɵ�����ͭ�������ͷ�Ӧ������������������ɼ����������������������
��1��������������ʽ������ɵ���֮��Ĺ�ϵʽ�ֱ�Ϊ��8HNO3��ϡ����3Cu��NO3��2��2NO��4HNO3��Ũ����Cu��NO3��2��2NO2���Ƚϲ��ѿ�����Ҫ�õ�������������ͭ���ĵ�ϡ�����٣��������ɵ������٣����A�Ϻã�
��2������Ƶõ�����ͭ������Ϊx��ԭϡ������Һ������HNO3������Ϊy
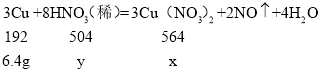
![]()
x��18.8g��y��16.8g
ϡ�����е���������������![]() ��100%=33.6%
��100%=33.6%
�𣺿����Ƶõ�����ͭ��������18.8g��ԭϡ���������ʵ�����������33.6%��