题目内容
有两种外观类似黄金的①Cu-Zn合金和②Cu-Ag合金制品,若实验室只提供一瓶稀硫酸和必要仪器.(1)你认为能测出合金______(填序号)中铜的质量分数;
(2)取上述(1)中的合金粉末20g放入烧杯中,加入50g的稀硫酸,恰好完全反应,测得烧杯内剩余物的质量为69.8g.
求:①产生氢气的质量;
②求出该合金中铜的质量分数.
【答案】分析:(1)因为①中的合金金属锌能与稀硫酸反应故可测出铜的质量分数,②中的银不能与硫酸反应不能测定铜的质量分数.
(2)产生氢气的质量是反应前后物质质量的变化,利用氢气的质量可求铜锌合金中锌的质量,然后利用这一质量对铜的质量分数进行求解即可.
解答:解:(1)要求铜的质量分数需能使另外一种金属与酸反应,则只能选①
故答案为:①
(2)由题意可知:Cu-Zn合金与稀硫酸完全反应产生氢气的质量为:
20g+50g-69.8g=0.2g
设产生0.2g氢气消耗金属锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
 =
=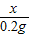
x=6.5g
合金中金属铜的质量为20g-6.5g=13.5g
所以合金中铜的质量分数为 ×100%=67.5%
×100%=67.5%
答:①产生氢气的质量为0.2g;
②该合金中铜的质量分数为67.5%.
点评:此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成氢气的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.
(2)产生氢气的质量是反应前后物质质量的变化,利用氢气的质量可求铜锌合金中锌的质量,然后利用这一质量对铜的质量分数进行求解即可.
解答:解:(1)要求铜的质量分数需能使另外一种金属与酸反应,则只能选①
故答案为:①
(2)由题意可知:Cu-Zn合金与稀硫酸完全反应产生氢气的质量为:
20g+50g-69.8g=0.2g
设产生0.2g氢气消耗金属锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
 =
=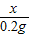
x=6.5g
合金中金属铜的质量为20g-6.5g=13.5g
所以合金中铜的质量分数为
 ×100%=67.5%
×100%=67.5%答:①产生氢气的质量为0.2g;
②该合金中铜的质量分数为67.5%.
点评:此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成氢气的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目