题目内容
三位同学分别用相同质量分数的稀盐酸,测定某石灰石样品中碳酸钙的质量分数(石灰石中的杂质既不与酸反应,也不溶于水).
(1)小敏的方法可用如图流程表示,测得的碳酸钙的质量分数为 ;
(2)小华取10g样品,用如图甲实验装置进行实验,反应结束后,测得B装置质量增加了4.6克,算得碳酸钙的质量分数,发现与事实严重不符,造成这种情况的可能原因是 .
(3)小军用如图乙的实验装置进行实验,将20克稀盐酸加入到1.25克样品中,生成的CO2体积与反应时间的关系如图丙.
①C装置中油层的作用是 ;
②已知本实验条件下CO2的密度为1.8克/升,求该石灰石样品中CaCO3的质量分数.
(1)小敏的方法可用如图流程表示,测得的碳酸钙的质量分数为

(2)小华取10g样品,用如图甲实验装置进行实验,反应结束后,测得B装置质量增加了4.6克,算得碳酸钙的质量分数,发现与事实严重不符,造成这种情况的可能原因是

(3)小军用如图乙的实验装置进行实验,将20克稀盐酸加入到1.25克样品中,生成的CO2体积与反应时间的关系如图丙.
①C装置中油层的作用是
②已知本实验条件下CO2的密度为1.8克/升,求该石灰石样品中CaCO3的质量分数.
考点:实验探究物质的组成成分以及含量,过滤的原理、方法及其应用,气体的净化(除杂),有关溶质质量分数的简单计算,盐的化学性质,根据化学反应方程式的计算
专题:科学探究,综合计算(图像型、表格型、情景型计算题)
分析:(1)根据盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,第二次加盐酸,滤渣继续减少,说明第一次中盐酸完全反应且碳酸钙有剩余,可知50g盐酸完全消耗5g碳酸钙,而第二次减少的质量为2.9g,说明碳酸钙完全反应,剩余滤渣的质量就是石灰石样品中杂质的质量进行解答;
(2)根据碱石灰能吸收水蒸气和氯化氢气体,B中吸收二氧化碳中带出的水蒸气和氯化氢气体进行解答;
(3)根据二氧化碳体积和密度求出二氧化碳的质量,利用二氧化碳的质量求出碳酸钙的质量,进而求出该石灰石样品中CaCO3的质量分数即可.
(2)根据碱石灰能吸收水蒸气和氯化氢气体,B中吸收二氧化碳中带出的水蒸气和氯化氢气体进行解答;
(3)根据二氧化碳体积和密度求出二氧化碳的质量,利用二氧化碳的质量求出碳酸钙的质量,进而求出该石灰石样品中CaCO3的质量分数即可.
解答:解:(1)盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,第二次加盐酸,滤渣继续减少,说明第一次中盐酸完全反应且碳酸钙有剩余,可知50g盐酸完全消耗5g碳酸钙,而第二次减少的质量为2.9g,说明碳酸钙完全反应,剩余滤渣的质量就是石灰石样品中杂质的质量.
的碳酸钙的质量分数=
×100%=79%;在过滤操作中,需要用到的玻璃仪器有漏斗、玻璃棒、烧杯;故填:79%;
(2)碱石灰能吸收水蒸气和氯化氢气体,B中吸收二氧化碳中带出的水蒸气和氯化氢气体,所以算得碳酸钙的质量分数,发现与事实严重不符;故填:B中吸收二氧化碳中带出的水蒸气和氯化氢气体;
(3)①C装置中油层的作用是防止二氧化碳溶于水;故填:防止二氧化碳溶于水;
②二氧化碳的质量=1.8g/L×0.244L≈0.44g,设碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 0.44g
=
x=1g
该石灰石样品中CaCO3的质量分数=
×100%=80%
答:该石灰石样品中CaCO3的质量分数为80%.
的碳酸钙的质量分数=
| 10g-2.1g |
| 10g |
(2)碱石灰能吸收水蒸气和氯化氢气体,B中吸收二氧化碳中带出的水蒸气和氯化氢气体,所以算得碳酸钙的质量分数,发现与事实严重不符;故填:B中吸收二氧化碳中带出的水蒸气和氯化氢气体;
(3)①C装置中油层的作用是防止二氧化碳溶于水;故填:防止二氧化碳溶于水;
②二氧化碳的质量=1.8g/L×0.244L≈0.44g,设碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 0.44g
| 100 |
| x |
| 44 |
| 0.44g |
x=1g
该石灰石样品中CaCO3的质量分数=
| 1g |
| 1.25g |
答:该石灰石样品中CaCO3的质量分数为80%.
点评:本题考查学生利用化学反应方程式的计算,明确二氧化碳是气体并利用质量守恒来计算二氧化碳的质量是解答的关键.

练习册系列答案
相关题目
在3A+B=2C+D的反应中已知30gA和10gB恰好完全反应,生成5gD且已知C的相对分子质量为70,则A的相对分子质量是( )
| A、20 | B、26 | C、40 | D、60 |

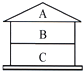 如图A、B、C三种物质,且上、下相邻的物质间均可发生反应.若B为CuO,A和C是不同种类的物质,且它们与B的反应属于不同的基本反应类型,写出相应的化学方程式,并分别指出所属的基本反应类型.
如图A、B、C三种物质,且上、下相邻的物质间均可发生反应.若B为CuO,A和C是不同种类的物质,且它们与B的反应属于不同的基本反应类型,写出相应的化学方程式,并分别指出所属的基本反应类型.
