题目内容
【题目】低血糖患者每天应注意摄入一定量的淀粉等化合物,以维持血液中的葡萄糖浓度一定。食用下列食品,可以较好地预防低血糖的是 ( )
①大米饭 ②花生仁 ③土豆片 ④玉米粥 ⑤鲜牛奶
A. ①②⑤ B. ①③④ C. ②③④ D. ①③④⑤
【答案】B
【解析】由题意,低血糖患者每天都应注意摄入一定量含淀粉的食物,以使血液中维持一定浓度的葡萄糖;大米饭、土豆片、玉米粥等食物中均富含淀粉。故选B。

【题目】掌握科学的研究方法,探索化学世界的奥秘.
(1)分类是学习化学的重要方法之一. ①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同) , 属于氧化物的是 .
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是 .
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
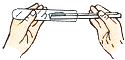
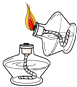
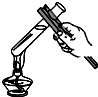
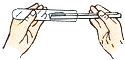
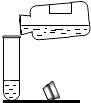
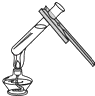
(2)实验是学习化学的一条重要途径,实验室中可用KClO3在MnO2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO2难溶于水) 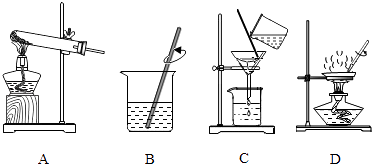
①图A中试管口略向下倾斜的原因是 , 图B操作中玻璃棒的作用是 .
②图C操作中的一处明显错误是 , 图D操作中,当看到 , 停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论. ①下列表述正确的是
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O2完全反应后,生成64g SO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO2和H2O,实验测得反应前后物质的质量如下表:
R | O2 | CO2 | H2O | |
反应前质量/g | 46 | 128 | 0 | 0 |
反应后质量/g | 0 | 32 | x | 54 |
则x= , 已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是 .