题目内容
某课外活动小组从海边盐滩上获得了一定量的粗盐,欲进行粗盐提纯的探究活动.请你参与其中,完成探究活动中的有关问题.
(1)查阅资料
①粗盐中含有较多的可溶性杂质(MgCl2、CaCl2等)和不溶性杂质(泥沙等).
②氯化钠在室温(20℃)时的溶解度为36.0g.
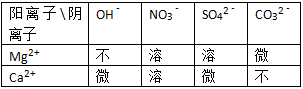
③Mg2+、Ca2+的碱和盐的溶解性(20℃)如下表:
| 阳离子\阴离子 | OH- | NO3- | SO42- | CO32- |
| Mg2+ | 不 | 溶 | 溶 | 微 |
| Ca2+ | 微 | 溶 | 微 | 不 |
(2)实验方案设计与问题讨论
①溶解(20℃)用托盘天平称取10.0g粗盐,用药匙将该粗盐逐渐加入到盛有10mL水的烧杯里,边加边搅拌,直到粗盐不再溶解为止.此时加入的粗盐质量至少是________g.
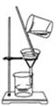
②除杂若要除去粗盐中的可溶性杂质CaCl2,可向其中加入过量的Na2CO3溶液;若要除去杂质MgCl2,可向其中加入过量的________溶液,然后按右图所示装置进行________操作.再向滤液中加入适量的________即得到氯化钠溶液.如果观察所得滤液是浑浊的,再过滤,仍浑浊,其可能的原因是:
 ________.
________.③蒸发
(3)实践实验操作过程略.
解:①根据溶解度的概念,氯化钠在室温(20℃)时的溶解度为36.0g,即100g水中最多溶解36g食盐,设10g水最少需要食盐的质量为x,就可以计算: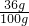 =
= ,解得x=3.6g,故答案为:3.6g
,解得x=3.6g,故答案为:3.6g
②若要除去杂质MgCl2,镁离子可以用氢氧根离子除去,可向其中加入过量的氢氧化钠溶液,生成的是氢氧化镁白色沉淀和氯化钠溶液;然后把沉淀过滤除去;最后再把过量的Na2CO3溶液和氢氧化钠溶液,用适量的稀盐酸除去即可.如果观察所得滤液是浑浊的,再过滤,仍浑浊,其可能的原因是:滤纸破损或液面高于滤纸的边缘等.故答案为:NaOH 过滤 盐酸(或HCl) 滤纸破损(或过滤液的液面高于滤纸边缘或其它合理答案)
分析:本题属于物质的净化除杂题,还包括了有关溶解度的计算和过滤操作.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.本题(1)查阅资料中告诉我们粗盐的成分,食盐在在室温(20℃)时的溶解度,这样有助于我们的计算;还告诉我们氢氧化镁和碳酸钙都不溶于水,有助于我们思考怎样除去钙离子和镁离子.本题的杂质是氯化钙和氯化镁,实际氯离子不是杂质,钙离子和镁离子才是杂质.由题意知,钙离子可以用碳酸根离子除去,镁离子可以用氢氧根离子除去;然后过滤,加入的过量的试剂可以用稀盐酸除去.
点评:本考点是物质的除杂、有关计算和操作问题,属于物质的分离和提纯的范畴.本考点的综合性比较强,是中考的一个难点,本题给出溶解性表,分步骤进行分离,同学们只要认真分析,根据除杂质的两个条件综合把握,并处理好加入的过量的试剂,掌握好实验基本操作,问题就不难解决了.本考点经常出现在填空题和实验题中.
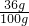 =
= ,解得x=3.6g,故答案为:3.6g
,解得x=3.6g,故答案为:3.6g②若要除去杂质MgCl2,镁离子可以用氢氧根离子除去,可向其中加入过量的氢氧化钠溶液,生成的是氢氧化镁白色沉淀和氯化钠溶液;然后把沉淀过滤除去;最后再把过量的Na2CO3溶液和氢氧化钠溶液,用适量的稀盐酸除去即可.如果观察所得滤液是浑浊的,再过滤,仍浑浊,其可能的原因是:滤纸破损或液面高于滤纸的边缘等.故答案为:NaOH 过滤 盐酸(或HCl) 滤纸破损(或过滤液的液面高于滤纸边缘或其它合理答案)
分析:本题属于物质的净化除杂题,还包括了有关溶解度的计算和过滤操作.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.本题(1)查阅资料中告诉我们粗盐的成分,食盐在在室温(20℃)时的溶解度,这样有助于我们的计算;还告诉我们氢氧化镁和碳酸钙都不溶于水,有助于我们思考怎样除去钙离子和镁离子.本题的杂质是氯化钙和氯化镁,实际氯离子不是杂质,钙离子和镁离子才是杂质.由题意知,钙离子可以用碳酸根离子除去,镁离子可以用氢氧根离子除去;然后过滤,加入的过量的试剂可以用稀盐酸除去.
点评:本考点是物质的除杂、有关计算和操作问题,属于物质的分离和提纯的范畴.本考点的综合性比较强,是中考的一个难点,本题给出溶解性表,分步骤进行分离,同学们只要认真分析,根据除杂质的两个条件综合把握,并处理好加入的过量的试剂,掌握好实验基本操作,问题就不难解决了.本考点经常出现在填空题和实验题中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某课外活动小组从海边盐滩上获得了一定量的粗盐,欲进行粗盐提纯的探究活动.请你参与其中,完成探究活动中的有关问题.
(1)查阅资料
①粗盐中含有较多的可溶性杂质(MgCl2、CaCl2等)和不溶性杂质(泥沙等).
②氯化钠在室温(20℃)时的溶解度为36.0g.
③Mg2+、Ca2+的碱和盐的溶解性(20℃)如下表:
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水.
(2)实验方案设计与问题讨论
①溶解(20℃)用托盘天平称取10.0g粗盐,用药匙将该粗盐逐渐加入到盛有10mL水的烧杯里,边加边搅拌,直到粗盐不再溶解为止.此时加入的粗盐质量至少是 g.
②除杂若要除去粗盐中的可溶性杂质CaCl2,可向其中加入过量的Na2CO3溶液;若要除去杂质MgCl2,可向其中加入过量的 溶液,然后按右图所示装置进行 操作.再向滤液中加入适量的 即得到氯化钠溶液.如果观察所得滤液是浑浊的,再过滤,仍浑浊,其可能的原因是: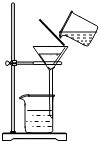 .
.
③蒸发
(3)实践实验操作过程略.
(1)查阅资料
①粗盐中含有较多的可溶性杂质(MgCl2、CaCl2等)和不溶性杂质(泥沙等).
②氯化钠在室温(20℃)时的溶解度为36.0g.
③Mg2+、Ca2+的碱和盐的溶解性(20℃)如下表:
| 阳离子\阴离子 | OH- | NO3- | SO42- | CO32- |
| Mg2+ | 不 | 溶 | 溶 | 微 |
| Ca2+ | 微 | 溶 | 微 | 不 |
(2)实验方案设计与问题讨论
①溶解(20℃)用托盘天平称取10.0g粗盐,用药匙将该粗盐逐渐加入到盛有10mL水的烧杯里,边加边搅拌,直到粗盐不再溶解为止.此时加入的粗盐质量至少是
②除杂若要除去粗盐中的可溶性杂质CaCl2,可向其中加入过量的Na2CO3溶液;若要除去杂质MgCl2,可向其中加入过量的

③蒸发
(3)实践实验操作过程略.
某课外活动小组从海边盐滩上获得了一定量的粗盐,欲进行粗盐提纯的探究活动.请你参与其中,完成探究活动中的有关问题.
(1)查阅资料
①粗盐中含有较多的可溶性杂质(MgCl2、CaCl2等)和不溶性杂质(泥沙等).
②氯化钠在室温(20℃)时的溶解度为36.0g.
③Mg2+、Ca2+的碱和盐的溶解性(20℃)如下表:
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水.
(2)实验方案设计与问题讨论
①溶解(20℃)用托盘天平称取10.0g粗盐,用药匙将该粗盐逐渐加入到盛有10mL水的烧杯里,边加边搅拌,直到粗盐不再溶解为止.此时加入的粗盐质量至少是______g.
②除杂若要除去粗盐中的可溶性杂质CaCl2,可向其中加入过量的Na2CO3溶液;若要除去杂质MgCl2,可向其中加入过量的______溶液,然后按右图所示装置进行______操作.再向滤液中加入适量的______即得到氯化钠溶液.如果观察所得滤液是浑浊的,再过滤,仍浑浊,其可能的原因是:______.
③蒸发
(3)实践实验操作过程略.
(1)查阅资料
①粗盐中含有较多的可溶性杂质(MgCl2、CaCl2等)和不溶性杂质(泥沙等).
②氯化钠在室温(20℃)时的溶解度为36.0g.
③Mg2+、Ca2+的碱和盐的溶解性(20℃)如下表:
| 阳离子\阴离子 | OH- | NO3- | SO42- | CO32- |
| Mg2+ | 不 | 溶 | 溶 | 微 |
| Ca2+ | 微 | 溶 | 微 | 不 |
(2)实验方案设计与问题讨论
①溶解(20℃)用托盘天平称取10.0g粗盐,用药匙将该粗盐逐渐加入到盛有10mL水的烧杯里,边加边搅拌,直到粗盐不再溶解为止.此时加入的粗盐质量至少是______g.
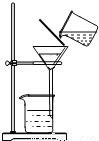
②除杂若要除去粗盐中的可溶性杂质CaCl2,可向其中加入过量的Na2CO3溶液;若要除去杂质MgCl2,可向其中加入过量的______溶液,然后按右图所示装置进行______操作.再向滤液中加入适量的______即得到氯化钠溶液.如果观察所得滤液是浑浊的,再过滤,仍浑浊,其可能的原因是:______.
③蒸发
(3)实践实验操作过程略.

某课外活动小组从海边盐滩上获得了一定量的粗盐,欲进行粗盐提纯的探究活动.请你参与其中,完成探究活动中的有关问题.
(1)查阅资料
①粗盐中含有较多的可溶性杂质(MgCl2、CaCl2等)和不溶性杂质(泥沙等).
②氯化钠在室温(20℃)时的溶解度为36.0g.
③Mg2+、Ca2+的碱和盐的溶解性(20℃)如下表:
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水.
(2)实验方案设计与问题讨论
①溶解(20℃)用托盘天平称取10.0g粗盐,用药匙将该粗盐逐渐加入到盛有10mL水的烧杯里,边加边搅拌,直到粗盐不再溶解为止.此时加入的粗盐质量至少是______g.
②除杂若要除去粗盐中的可溶性杂质CaCl2,可向其中加入过量的Na2CO3溶液;若要除去杂质MgCl2,可向其中加入过量的______溶液,然后按右图所示装置进行______操作.再向滤液中加入适量的______即得到氯化钠溶液.如果观察所得滤液是浑浊的,再过滤,仍浑浊,其可能的原因是:______.
③蒸发
(3)实践实验操作过程略.
(1)查阅资料
①粗盐中含有较多的可溶性杂质(MgCl2、CaCl2等)和不溶性杂质(泥沙等).
②氯化钠在室温(20℃)时的溶解度为36.0g.
③Mg2+、Ca2+的碱和盐的溶解性(20℃)如下表:
| 阳离子\阴离子 | OH- | NO3- | SO42- | CO32- |
| Mg2+ | 不 | 溶 | 溶 | 微 |
| Ca2+ | 微 | 溶 | 微 | 不 |
(2)实验方案设计与问题讨论
①溶解(20℃)用托盘天平称取10.0g粗盐,用药匙将该粗盐逐渐加入到盛有10mL水的烧杯里,边加边搅拌,直到粗盐不再溶解为止.此时加入的粗盐质量至少是______g.
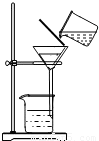
②除杂若要除去粗盐中的可溶性杂质CaCl2,可向其中加入过量的Na2CO3溶液;若要除去杂质MgCl2,可向其中加入过量的______溶液,然后按右图所示装置进行______操作.再向滤液中加入适量的______即得到氯化钠溶液.如果观察所得滤液是浑浊的,再过滤,仍浑浊,其可能的原因是:______.
③蒸发
(3)实践实验操作过程略.