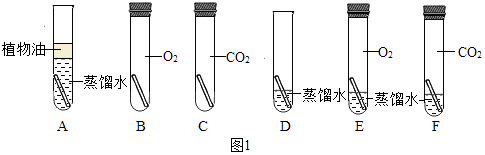
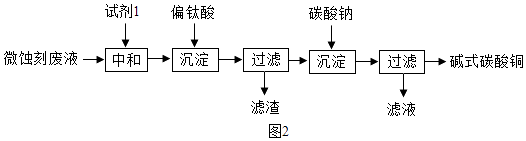
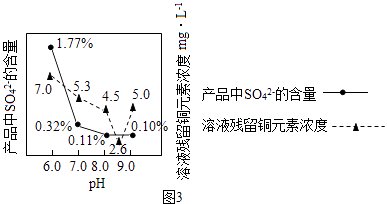
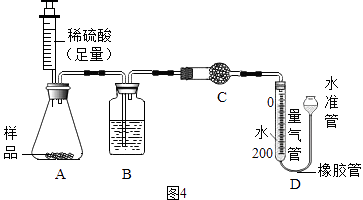
题目内容
【题目】一包白色固体可能含有 Ba(NO3)2、NaCl、NaOH、Na2SO4、CuSO4 中的一种或几种.为确定 其组成,某同学设计了如下实验方案: 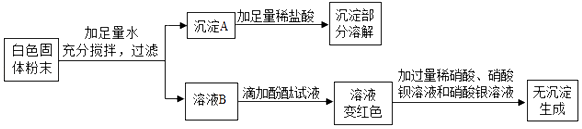
下列判断正确的是( )
A.原固体中一定有 Ba(NO3)2、NaOH、CuSO4 和 Na2SO4
B.沉淀 A 中一定有 Cu(OH) 2 和 BaSO4
C.溶液 B 中一定有 NaOH 和 Na2SO4 , 一定没有 CuSO4
D.原固体中一定没有 NaCl 和 Na2SO4
【答案】B
【解析】解:硫酸铜和氢氧化钠反应生成蓝色的氢氧化铜沉淀,氢氧化铜沉淀溶于酸,硝酸钡和硫酸钠反应生成不溶于酸的硫酸钡沉淀,碱能使酚酞变红色,硫酸根离子和钡离子反应硫酸钡沉淀,氯离子和银离子反应会生成氯化银沉淀.白色固体粉末加入足量的水水后,得到沉淀A和溶液B,沉淀A中加入稀盐酸,部分溶解,所以沉淀A中一定含有氢氧化铜沉淀和硫酸钡沉淀,白色固体粉末中一定含有硝酸钡、氢氧化钠、硫酸铜,可能含有硫酸钠,溶液B中加入酚酞,溶液变红色,所以B中一定含有氢氧化钠,加入足量的硝酸、硝酸钡、硝酸银,无沉淀生成,所以白色固体粉末中一定不含氯化钠,所以 A、原固体中一定有 Ba(NO3)2、NaOH、CuSO4 , 可能含有Na2SO4 , 故A错误;
B、沉淀A中一定有 Cu(OH) 2 和 BaSO4 , 故B正确;
C、溶液B中一定有 NaOH,一定没有Na2SO4和CuSO4 , 故C错误;
D、原固体中一定没有NaCl,可能含有Na2SO4 , 故D错误.
故选:B.
根据硫酸铜和氢氧化钠反应生成蓝色的氢氧化铜沉淀,氢氧化铜沉淀溶于酸,硝酸钡和硫酸钠反应生成不溶于酸的硫酸钡沉淀,碱能使酚酞变红色,硫酸根离子和钡离子反应硫酸钡沉淀,氯离子和银离子反应会生成氯化银沉淀等知识进行分析.