题目内容
【题目】九年级同学在实验室做铁丝在氧气中燃烧实验。

(1)铁丝在氧气中燃烧的化学方程式为________________________。
(2)铁丝在氧气中燃烧的现象是______________;某同学在实验时只发现铁丝红热一下,没有观察到其他现象,铁丝没有燃烧的可能原因是_______________;
(3)某小组的同学在实验后发现集气瓶底破裂,可能的原因是__________。
【答案】3Fe+3O2![]() Fe3O4 剧烈燃烧,火星四射,放出大量的热,生成黑色固体 未除铁锈(或伸入过慢或氧气不纯等合理即可) 瓶底没有放水或沙子
Fe3O4 剧烈燃烧,火星四射,放出大量的热,生成黑色固体 未除铁锈(或伸入过慢或氧气不纯等合理即可) 瓶底没有放水或沙子
【解析】
(1)铁丝在氧气中燃烧生成黑色的四氧化三铁,其化学方程式为:3Fe+3O2![]() Fe3O4。故填:3Fe+3O2
Fe3O4。故填:3Fe+3O2![]() Fe3O4
Fe3O4
(2)铁丝在氧气中燃烧的现象是剧烈燃烧,火星四射,放出大量的热,生成黑色固体;某同学在实验时只发现铁丝红热一下,没有观察到其他现象,铁丝没有燃烧的可能原因是铁丝未除铁锈(或伸入过慢或氧气不纯等合理即可)等。故填:剧烈燃烧,火星四射,放出大量的热,生成黑色固体;未除铁锈(或伸入过慢或氧气不纯等合理即可)
(3)集气瓶底破裂原因是瓶底没有放水或沙子,高温溅落物掉落使集气瓶受热不均而炸裂。故填:瓶底没有放水或沙子

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】(1)硫在氧气中燃烧的化学方程式是: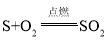 。表示了参与反应的各物质之间的质量关系,即在点燃条件下,每____份质量的硫与____份质量的氧气恰好完全反应生成_____份质量的二氧化硫
。表示了参与反应的各物质之间的质量关系,即在点燃条件下,每____份质量的硫与____份质量的氧气恰好完全反应生成_____份质量的二氧化硫
(2)化学反应前后必定没有发生改变的是______(填字母)
①原子数目 ②分子数目 ③元素种类 ④物质种类 ⑤原子种类 ⑥物质的总质量
A ①④⑥
B ①③⑤⑥
C ①②⑥
D ②③⑤
(3)某纯净物X在空气中完全燃烧,反应的化学方程式为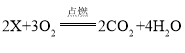 ,则X的化学式为____________。
,则X的化学式为____________。
(4)密闭容器中有甲、乙两种物质各10g,加热一段时间后测得容器中各物质的质量如下表所示:
物质 | 甲 | 乙 | 丙 | 丁 |
反应后的质量/g | 1.5 | X | 0.8 | 2.2 |
下列选项正确的是(________)
A 该反应为化合反应
B X=54
C 丙、丁一定是单质
D 甲一定是化合物
【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
(查阅资料)
a. 固体酒精是用酒精、氢化钙和氢氧化钠按一定的质量比混合制成。
b. 氯化钙、氯化钠溶液均呈中性。

(提出问题)
①酒精中是否含有碳元素? ②固体酒精中的氢氧化钠是否变质?
(实验探究)
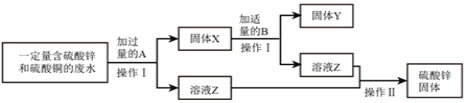
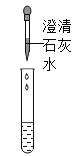
①按上图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精精中含有碳元素的结论,理由是__________。
②取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的:__________________________,由此说明氢氧化钠已变质。
③为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按如图所示方案进行实验。
实验方案 |
|
|
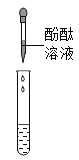
实验现象 | 溶液变红 | 产生_____________ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组同学实验不能证明清液中一定含有氢氧化钠,理由是_____________________。乙组同学另取烧杯中上层清液,加足量氯化钙溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)
乙组实验中加足量氯化钙溶液的目的是_______________。
(实验结论)
甲乙两小组同学经过讨论,一致认为该固体酒精中的氢氧化钠________(填“没有”、“部分”或“全部”)变质。
【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:氧化铜能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
(猜想和假设)
猜想Ⅰ氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
猜想Ⅱ氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
猜想Ⅲ氧化铜是反应的催化剂,反应前后________________。
(进行实验)
用天平称量![]() 氧化铜,取
氧化铜,取![]() 的过氧化氢溶液于试管中,进行如下实验:
的过氧化氢溶液于试管中,进行如下实验:
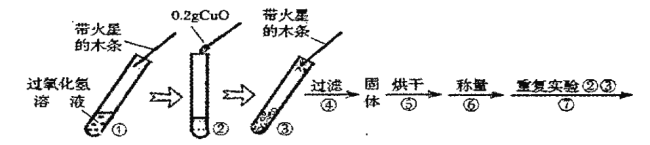
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
溶液中有气泡放出,带火星的木条复燃 | ___________________ | ____________ | 猜想Ⅰ、Ⅱ不成立;猜想Ⅲ成立. |
(2)步骤①的目的是______________________。步骤⑦的目是_______________。
(3)请写出该实验中反应的化学符号(或文字)表达式______________________。