题目内容
【题目】某兴趣小组利用传感器二氧化碳性质再探究。实验步骤如下:
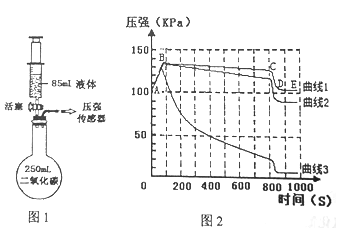
(1)如图1所示装置的气密性良好,三瓶250mL的烧瓶内收集满CO2气体,三个注射器内各装有85mL的液体(分别是水、饱和石灰水、40%的氢氧化钠溶液)。连接好装置和压强传感器。
(2)三位同学同时迅速将注射器内85mL的液体(水、饱和石灰水、40%的氢氧化钠溶液)注入各自烧瓶中,关闭活塞。
(3)一段时间后,同时振荡烧瓶。观察传感器定量实时地传回烧瓶内气压变化形成的图情况如图2所示。试回答下列问题:
(1)导致曲线1中CD段气压急速减小的操作是________________________。不改变装置药品的情况下,进一步降低E点的方法是______________________________________________。
(2)曲线2中发生的反应方程式为_________________________________。曲线2与曲线3差异较大的原因是_______________________________________________。
(3)对比曲线1、2、3,不能得出的结论是________________。
①CO2能与水发生反应;②1体积水约溶解1体积CO2;③CO2能与NaOH溶液发生反应;
④检验CO2用饱和澄清石灰水较合适;⑤吸收CO2用NaOH溶液较合适
(4)已知本实验中提供的氢氧化钠溶液足量,Y则烧瓶内250mLCO2气体理论上最多能生成的碳酸钠质量为多少?(本实验条件中CO2的密度约为2g/L,最后计算结果保留一位小数)_______
【答案】 振荡烧瓶 使烧瓶内物质冷却 CO2+Ca(OH)2==CaCO3↓+H2O 饱和石灰水浓度太低(氢氧化钙微溶于水)影响了二氧化碳的吸收 )①④ 1.2g
【解析】(1)振荡烧瓶是增大了吸收面积,CD段气压急速减小;不改变装置药品的情况下,进一步降低E点,即进一步降低压强,可以使烧瓶内物质冷却;
(2)曲线2对二氧化碳的吸收量居中,说明液体是石灰水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;由于饱和石灰水浓度太低(氢氧化钙微溶于水)影响了二氧化碳的吸收,所以曲线3为40%的氢氧化钠溶液;
(3)根据曲线1前后压强几乎不变,可得1体积水约溶解1体积CO2;相同体积水和氢氧化钠溶液时对比曲线1、3,发现氢氧化钠溶液时,压强减小的大,说明CO2能与NaOH溶液发生反应;对比曲线1、2、3,曲线3压强降得最大,说明吸收二氧化碳最多,吸收CO2用NaOH溶液较合适;
(4)二氧化碳体积=250mL=0.25L
二氧化碳质量=0.25L×2g/L=0.5g
设碳酸钠的质量为X,
CO2+2NaOH==Na2CO3+H2O
44 106
0.5g X
![]()
X= 1.2g
答:生成碳酸钠质量最多为1.2g 。

【题目】下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
A. 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B. 在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C. 从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D. 分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液