题目内容
【题目】空气与人类息息相关。
(1)洁净的空气属于_________(填“混合物”或“纯净物”)。
(2)下图示实验能用来测定空气里氧气的含量,其化学变化方面的依据主要有以下两条:
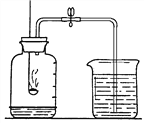
①磷与氧气能反应,化学方程式为_______________;
②红磷不能与空气中的________________发生反应。
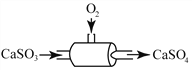
(3)氧气可用于烟气脱硫工艺(如下图),图中反应的化学方程式为2CaSO3 + O2 == 2CaSO4 。反应物CaSO3中S元素的化合价是_____,生成物CaSO4读作____________。若有0.6t CaSO3参加反应,则至少需要消耗氧气_______________ ?(写出计算过程及结果)
【答案】 混合物 4P + 5O2 ![]() 2P2O5 其他气体 +4 硫酸钙 0.08t
2P2O5 其他气体 +4 硫酸钙 0.08t
【解析】(1)洁净的空气中含有氮气、氧气、二氧化碳、稀有气体等物质,属于混合物;(2)红磷在空气中燃烧生成五氧化二磷,反应的化学方程式:4P + 5O2 ![]() 2P2O5;红磷不能与空气中的其他气体发生反应;(3)设CaSO3中硫元素化合价为x,钙元素化合价是+ 2,氧元素化合价是-2,根据化合物中元素化合价代数和为零有: +2+x+(-2) ×3=0,x=+4 ;生成物的CaSO4读作硫酸钙。设至少需要消耗氧气的质量为y,
2P2O5;红磷不能与空气中的其他气体发生反应;(3)设CaSO3中硫元素化合价为x,钙元素化合价是+ 2,氧元素化合价是-2,根据化合物中元素化合价代数和为零有: +2+x+(-2) ×3=0,x=+4 ;生成物的CaSO4读作硫酸钙。设至少需要消耗氧气的质量为y,
2CaSO3+O2= 2CaSO4
240 32
0.6t y
![]()
y=0.08t。
答: 需要消耗0.08氧气。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目


