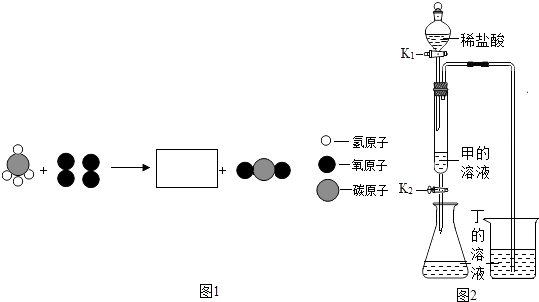
题目内容
【题目】请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题: 
(1)实验所用稀盐酸的溶质的质量分数为 .
(2)计算原混合物样品中CaCl2的质量(写出计算过程).
【答案】
(1)7.3%
(2)解:设原混合物中 CaCO3的质量为x
CaCO3 | + | 2HCl | = | CaCl2 | + | H2O | + | CO2↑ |
73 | 44 | |||||||
100gy | 4.4g |
![]() =
= ![]()
解得:x=10g
所以原混合物样品中CaCl2的质量为:12g﹣10g=2g
答:原混合物样品中CaCl2的质量为2g
【解析】解(1)反应中生成CO2的质量为:12g+100g+100g﹣207.6g=4.4g, 设盐酸的质量分数为y
CaCO3 | + | 2HCl | = | CaCl2 | + | H2O | + | CO2↑ |
73 | 44 | |||||||
100gy | 4.4g |
![]()
解得:y=7.3%;
(1)根据图中信息可以知道,反应前加入的物质的总质量为:12g+100g+100g=212g,而反应后剩余物质的总质量为207.6g,根据质量守恒定律可以知道物质减少的质量为生成二氧化碳的质量,可以据此求算出盐酸的质量分数;(2)根据二氧化碳的质量结合化学方程式可以求算出碳酸钙的质量,进而可以求出氯化钙的质量.

【题目】在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参与反应且不溶于水)和纯碱为原材料制取烧碱,其制取流程如图: 
(1)写出加入纯碱溶液后发生反应的化学方程式:;
(2)[问题与发现]固体A是纯净的氢氧化钠吗? [猜想与假设]根据反应原理,同学们提出以下猜想:
甲的猜想:A是纯净的氢氧化钠固体.
乙的猜想:A是氢氧化钠和氢氧化钙的混合物.
你的猜想: .
[实验验证]
实验操作 | 现象 | 结论 | |
甲 | 取少量固体A,用适量水溶解后,滴加几滴无色酚酞溶液 | 溶液变红 | 猜想成立 |
乙 | 取少量固体A,用适量水溶解后,滴加几滴饱和碳酸钠溶液 | 猜想不成立 | |
你 | 猜想成立 |
[反思与评价]同学们讨论后,认为甲的结论不一定成立,原因是 .
【题目】化学小组的同学欲探究二氧化碳与氢氧化钠能否反应,实验方案如下:
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器1中的溶液推入充有CO2的瓶中 | 气球鼓起 |
② | 无明显现象 | |
③将注射器2中的溶液推入瓶中 | 溶液中有气泡产生,气球变瘪 | |
④向外注射器3 | 澄清石灰水变浑浊 |
(1)步骤①中气球鼓起的原因可能是 .
(2)步骤②中的操作是 , 其目的是证明步骤Ⅰ中装置内的CO2已被完全吸收.
(3)步骤④中发生反应的化学方程式为 .
(4)本实验的结论是 .