题目内容
【题目】为减少污染并变废为宝,某化学小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸锌的实验.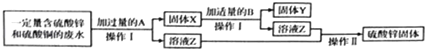
(1)X的成分为;操作Ⅰ需用的玻璃仪器有烧杯、玻璃棒和 .
(2)加入B时反应的化学方程式为 .
(3)操作Ⅱ中玻璃棒的作用是 .
【答案】
(1)锌、铜;漏斗
(2)Zn+H2SO4=ZnSO4+H2↑
(3)搅拌,防止局部过热,造成液滴飞溅
【解析】(1)锌和硫酸铜反应生成硫酸锌和铜,所以加入的A是锌,所以X的成分为锌、铜,操作Ⅰ分离出了固体和溶液,所以操作I是过滤,需用的玻璃仪器有烧杯、玻璃棒和漏斗;(2)加入过量的锌可以跟硫酸铜完全反应,但是过量的锌对于铜仍是杂质,锌和稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;(3)从溶液中得到固体的方法是蒸发,所以操作Ⅱ中玻璃棒的作用是搅拌,防止局部过热,造成液滴飞溅.
所以答案是:(1)锌、铜,漏斗;(2)Zn+H2SO4=ZnSO4+H2↑;(3)搅拌,防止局部过热,造成液滴飞溅.
【考点精析】关于本题考查的过滤操作的注意事项和蒸发操作的注意事项,需要了解过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;蒸发注意点:1、在加热过程中,用玻璃棒不断搅拌2、当液体接近蒸干(或出现较多量固体)时停止加热,利用余热将剩余水分蒸发掉,以避免固体因受热而迸溅出来.3、热的蒸发皿要用坩埚钳夹取,热的蒸发皿如需立即放在实验台上,要垫上石棉网才能得出正确答案.

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组发现铜片在加热的条件下可以与浓硫酸反应,产生气泡并闻到刺激性气味,铜片溶解,溶液呈蓝色,请你参与实验探究.
【查阅资料】SO2是一种无色,有刺激性气味,有毒的气体.
【提出问题】产生的气体是什么?
(1)【提出猜想】猜想一:SO2;猜想二:SO2和H2 .
你认为猜想二(填:“正确”或“错误”).
(2)【提出问题】蓝色溶液的溶质是什么?
【提出猜想】猜想一:CuSO4;猜想二:CuSO4和H2SO4 .
【进行实验】取一定量反应后的溶液进行稀释,并分装在A、B两支试管中,然后进行下列实验,并完成如表:
步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤一 | 在试管A中加入少量的CuO粉末 | ① | 溶液中含有H2SO4 |
步骤二 | 在试管B中加入过量的NaOH溶液 | ② | 溶液中含有CuSO4 |
(3)【探究结论】通过实验,猜想二正确.
①写出步骤一发生反应的化学方程式: .
②完成并配平方程式:Cu+H2SO4(浓) .
(4)【反思评价】根据化学方程式:小王认为工业上可以用铜和浓硫酸反应大量制取硫酸铜,小李认为不适宜,理由是 .
