题目内容
 在学习了盐的性质以后,某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数的探究实验.他们设计如下的实验方案:
在学习了盐的性质以后,某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数的探究实验.他们设计如下的实验方案:【方案一】气体分析法
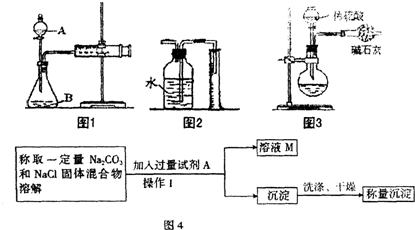
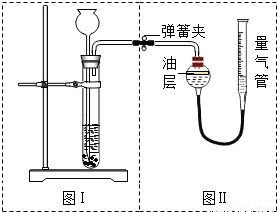
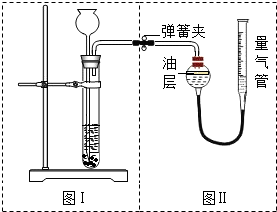
将样品与稀盐酸反应,测定反应后生成CO2的体积,经换算并计算出样品中Na2CO2的质量.用右图装置测定产生的CO2气体的体积.
(1)判断图Ⅱ所示装置气密性良好的方法.
(2)请分析图Ⅱ装置中油层的作用是
【方案二】沉淀分析法
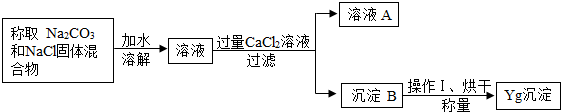
(1)溶液A中的溶质有
(2)操作Ⅰ是
(3)若缺少操作Ⅰ,会导致测定结果
(4)若加入的CaCl2溶液的量不足,会导致测定结果
【方案三】盐酸滴定法
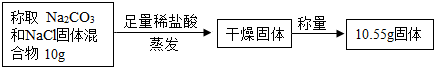
(1)用已知浓度盐酸滴加到一定质量的混合物,根据消耗盐酸溶液的体积来测定碳酸钠的含量.在实验过程中判断反应所滴加的稀盐酸恰好与碳酸钠反应的方法是
(2)晓红同学通过实验测定了一些数据,试根据下面的实验数据计算Na2CO3的质量分数.称取Na2CO3和NaCl固体混合物10g足量稀盐酸蒸发干燥固体称量10.55g固体.
分析:【方案一】(1)利用液封法可以鉴定装置的气密性.(2)二氧化碳能溶于水容易导致测量数据不准确
【方案二】(1)利用物质之间的反应解决
(2)为使测量的数据准确故从溶液中出来的固体应洗去表面的残夜
(3)不经过洗涤制得的固体可能偏大
(4)加入的CaCl2溶液的量不足时,得到的沉淀量会偏小
【方案三】(1)盐酸溶液与碳酸钠的反应会生成气泡这一明显现象,(2)利用反应方程式反应前后固体的质量差进行解决
【方案二】(1)利用物质之间的反应解决
(2)为使测量的数据准确故从溶液中出来的固体应洗去表面的残夜
(3)不经过洗涤制得的固体可能偏大
(4)加入的CaCl2溶液的量不足时,得到的沉淀量会偏小
【方案三】(1)盐酸溶液与碳酸钠的反应会生成气泡这一明显现象,(2)利用反应方程式反应前后固体的质量差进行解决
解答:解:【方案一】(1)考查气密性的检查方法:关闭活塞,将水注入量气管中,一段时间后量气管中形成一段液柱,且液柱不再下降,即表明该装置气密性较好.
(2)因CO2能溶于水且与水反应,导致结果偏小;改进方案是将广口瓶中的水改为饱和的CO2水溶液或在水面上覆盖一层植物油等.
故答案为:因为CO2能溶于水且与水反应,导致结果偏小,用植物油可避免二氧化碳与水的结合
【方案二】(1)碳酸钠与氯化钙反应时产物是氯化钠,另外还有剩余的氯化钙
故答案为:NaCl和过量的CaCl2.
(2)为防止沉淀表面存有残夜,需才用清水洗净固体表面,否则会导致沉淀量数据不准确
故答案为:洗涤
(3)表面有残夜时会使沉淀量变大,进而导致计算的碳酸钠质量变大
故答案为:偏大
(4)加入的CaCl2溶液的量不足时,得到的沉淀量会偏小,从而导致计算的碳酸钠偏小
故答案为:偏小
【方案三】(1)盐酸滴加到溶液中会与碳酸钠反应生成二氧化碳气泡这一现象非常明显
故答案为:直到不再生成气泡为止
(2)设原固体混合物中NaCl的质量为x,则参加反应的Na2CO3的质量为10-x,生成的NaCl质量为10.55g-x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117
10g-x 10.55g-x
=
x=4.7g
所以Na2CO3的质量分数为
×100%=53%.
答;碳酸钠的质量分数为53%
(2)因CO2能溶于水且与水反应,导致结果偏小;改进方案是将广口瓶中的水改为饱和的CO2水溶液或在水面上覆盖一层植物油等.
故答案为:因为CO2能溶于水且与水反应,导致结果偏小,用植物油可避免二氧化碳与水的结合
【方案二】(1)碳酸钠与氯化钙反应时产物是氯化钠,另外还有剩余的氯化钙
故答案为:NaCl和过量的CaCl2.
(2)为防止沉淀表面存有残夜,需才用清水洗净固体表面,否则会导致沉淀量数据不准确
故答案为:洗涤
(3)表面有残夜时会使沉淀量变大,进而导致计算的碳酸钠质量变大
故答案为:偏大
(4)加入的CaCl2溶液的量不足时,得到的沉淀量会偏小,从而导致计算的碳酸钠偏小
故答案为:偏小
【方案三】(1)盐酸滴加到溶液中会与碳酸钠反应生成二氧化碳气泡这一现象非常明显
故答案为:直到不再生成气泡为止
(2)设原固体混合物中NaCl的质量为x,则参加反应的Na2CO3的质量为10-x,生成的NaCl质量为10.55g-x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117
10g-x 10.55g-x
| 106 |
| 117 |
| 10g-x |
| 10.5g-x |
x=4.7g
所以Na2CO3的质量分数为
| 10g-4.7g |
| 10g |
答;碳酸钠的质量分数为53%
点评:此题涉及到实验的常规操作,相关的物质的分离设计了三种方式,纵纵观这些方式实际还是与物质之间的反应有关系,因此学好物质间的联系是酸碱盐知识的关键.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目