题目内容
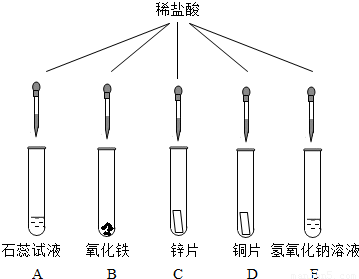
17、某同学进行了如下图所示的探究实验: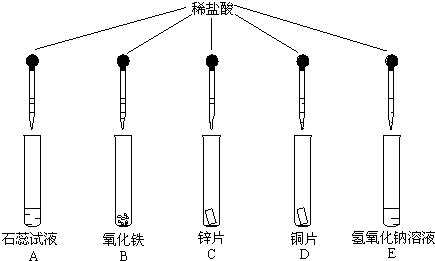
(1)B试管中发生反应的化学方程式是
(2)C、D试管中可能发生反应的化学方程式是
(3)E试管中无明显现象,该同学据此推断稀盐酸不与氢氧化钠反应,此结论是否正确?
请你选用图中所出现过的药品(可重新取样),设计一个实验证明你的判断.

(1)B试管中发生反应的化学方程式是
Fe2O3+6HCl=FeCl3+3H2O
,请写出与该反应原理有关的盐酸的一个用途:除锈
.(2)C、D试管中可能发生反应的化学方程式是
Zn+2HCl=ZnCl2+H2↑
;通过这两支试管的实验可得出的结论是
金属活动性:Zn>Cu
.(3)E试管中无明显现象,该同学据此推断稀盐酸不与氢氧化钠反应,此结论是否正确?
不正确
.请你选用图中所出现过的药品(可重新取样),设计一个实验证明你的判断.

分析:稀盐酸的有关的化学性质有:能够使紫色石蕊试液变红,能够和金属氧化物反应生成盐和水,能够和活泼金属(在金属活动性顺序中氢前的)反应生成盐和氢气,能和碱反应生成盐和水等.
解答:解:(1)由于酸和金属氧化物反应生成盐和水,故答案为:Fe2O3+6HCl=2FeCl3+3H2O,除锈;
(2)由于盐酸和在金属活动性顺序中氢前的金属反应生成盐和氢气,故答案为:Zn+2HCl=ZnCl2+H2↑,金属活动性Zn>Cu;
(3)没有明显现象并不能说明物质间没有发生化学反应,我们可以利用酸碱指示剂或者利用证明是否有新的物质生成来证明反应是否发生,故答案为:不正确;
①在滴有石蕊试液的氢氧化钠溶液中逐渐加入稀盐酸;液体由蓝色变为紫色或红色,说明盐酸和氢氧化钠发生了反应;
②在稀盐酸中加入足量氢氧化钠溶液,再将所得液体倒入放有锌片的试管中;锌片表面没有气泡冒出,说明盐酸和氢氧化钠发生了反应.
(回答出一种并合理即可,实验步骤须与现象和结论对应)
(2)由于盐酸和在金属活动性顺序中氢前的金属反应生成盐和氢气,故答案为:Zn+2HCl=ZnCl2+H2↑,金属活动性Zn>Cu;
(3)没有明显现象并不能说明物质间没有发生化学反应,我们可以利用酸碱指示剂或者利用证明是否有新的物质生成来证明反应是否发生,故答案为:不正确;
①在滴有石蕊试液的氢氧化钠溶液中逐渐加入稀盐酸;液体由蓝色变为紫色或红色,说明盐酸和氢氧化钠发生了反应;
②在稀盐酸中加入足量氢氧化钠溶液,再将所得液体倒入放有锌片的试管中;锌片表面没有气泡冒出,说明盐酸和氢氧化钠发生了反应.
(回答出一种并合理即可,实验步骤须与现象和结论对应)
点评:本题难度较大,主要考查了酸的化学性质特别是酸和碱发生的中和反应,主要培养学生分析问题、应用知识解决问题的能力.

练习册系列答案
相关题目
 (2012?朝阳区一模)在化学实验技能考试中,有一题目是鉴别氢氧化钙溶液和氢氧化钠溶液,某同学进行了如下图所示的实验.
(2012?朝阳区一模)在化学实验技能考试中,有一题目是鉴别氢氧化钙溶液和氢氧化钠溶液,某同学进行了如下图所示的实验.