��Ŀ����
����Ŀ���� 128 ������ء�60 ���Ȼ�����ɵĻ����Ͷ�� 200g ��ˮ�ܽ⣬�Ը���Һ������ͼʵ�飨����ʵ�����������ģ���
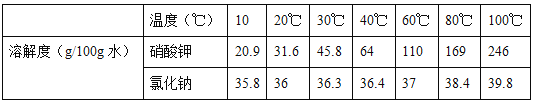
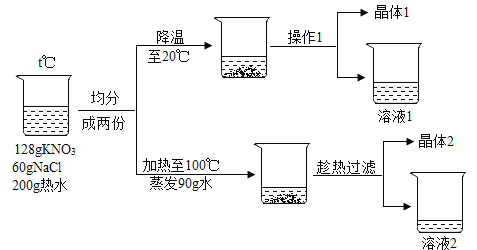
��1�����������ܽ���ˮ�У��ò����������Ŀ����_____��
��2��ʵ��ʱ�¶� t �ķ�ΧΪ_____��
��3������ 1 �õ���ʵ��������_____��
A.�ƾ��� B. ����̨ C. ©�� D. ������ E. ������
��4�������������� 1 �����_____��
��5����Һ 2 Ϊ_____�����������ƣ��ı�����Һ��
��6��������Һ�� NaCl ��������������Һ 1_____��Һ 2��ѡ�>������<����=������
��7����������ʵ��˵���������_____��
A.����1�뾧��2�Ƚϣ�����1��KNO3�Ĵ��ȸ���
B.��Һ1��KNO3Ϊ������Һ��NaClΪ��������Һ
C.��Һ1��������90gˮ������Һ2�ijɷ���ͬ
D.��Һ2��ˮ���ɾͿɵõ�������KNO3����
���𰸡������ܽ� 40����t��100�� BCD 32.4gKNO3 ����ء��Ȼ��� < CD
��������
��1���ܽ�������ò����������Ŀ���Ǽ����ܽ⡣
��2��ʵ��ʱ200g ��ˮ�ܽ���128 ������ء�60 ���Ȼ��ƣ��൱��100g ��ˮ�ܽ���64 ������ء�30 ���Ȼ��ƣ���40��ʱ����ص��ܽ����64g���Ȼ��Ƶ��ܽ����36.4g���������ʵ��ܽ�ȶ����¶ȵ����߶����������¶� t �ķ�ΧΪ40����t��100�档
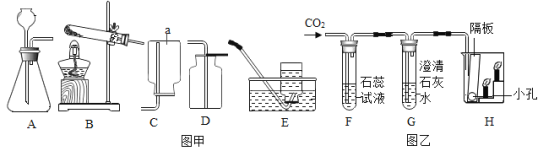
��3��ͨ�����˿ɽ�������Һ����룬���� 1�ǹ��ˣ�����ʱ�õ���ʵ������������̨��©��������������ѡBCD ��
��4��200g ��ˮ�ܽ���128 ������ء�60 ���Ȼ��ƣ�ƽ���ֳ����ݣ�ÿ���к���100g ˮ��64 ������ء�30 ���Ȼ��ƣ���20��ʱ����ص��ܽ����31.6g���Ȼ��Ƶ��ܽ����36g��������Һ1�к���100gˮ��31.6g����ء�30 ���Ȼ��ƣ����� 1�к���64 g-31.6g=32.4g����ء�
��5��200g ��ˮ�ܽ���128 ������ء�60 ���Ȼ���ƽ���ֳ����ݣ�ÿ���к���100g ˮ��64 ������ء�30 ���Ȼ��ƣ�������100������90gˮ��ʣ��10gˮ������ܽ�ȿ�֪��100��10gˮ������ܽ�24.6g����ء�3.98g�Ȼ��ƣ�����2�к�������ء��Ȼ��ƣ�������������Һ�DZ�����Һ��������Һ 2Ϊ����ء��Ȼ��Ƶı�����Һ��
��6����Һ 1��20��ʱ�Ȼ��ƵIJ�������Һ����Һ 2��100��ʱ�Ȼ��Ƶı�����Һ���Ȼ�����100��ʱ���ܽ�ȴ�����20��ʱ���ܽ�ȣ���ѡ��<����
��7��A. ���� 1ֻ��������أ� ���� 2 �к�������ء��Ȼ��ƣ����Ծ��� 1 ��KNO3 �Ĵ��ȸ��ߣ���ѡ����ȷ��B. ��Һ 1 ��KNO3 Ϊ������Һ��NaCl Ϊ��������Һ����ѡ����ȷ��C. ��Һ 1 ����Һ 2 ���¶Ȳ�ͬ�����ʵ��ܽ�Ȳ���ȣ�������Һ 1 ����Һ 2 �ijɷֲ���ͬ����ѡ�����D. ��Һ 2 �к�������ء��Ȼ��ƣ���ˮ���ɵõ�KNO3 ��NaCl�Ĺ��������ѡ�����ѡCD��

 Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д� �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�����Ŀ����ѧѧϰС����ʵ��������ȸ��������ȡ��������Ӧ�����в��ʣ��������������ʱ���ϵ��ͼ��ʾ������㣺

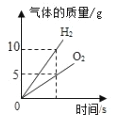
��1���������Ƶ�����������___________��
��2��ͼ����a����ֵΪ_________________��
��3��ʱ��Ϊt1ʱ��������Ԫ�ص�����_________g��
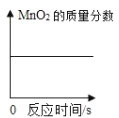
��4����Ӧ�������MnO2����������Ϊ__________������ȷ��0.01%��
��5�������Ǽ���ҩƷ�ļ۸���ʵ����Ҫ��ȡ96g����������������ҩƷ��Ƚϻ��㣿___________
ҩƷ | ������� | ����� | ˫��ˮ��30%�� |
�۸�Ԫ��/kg | 113.4 | 84 | 54 |