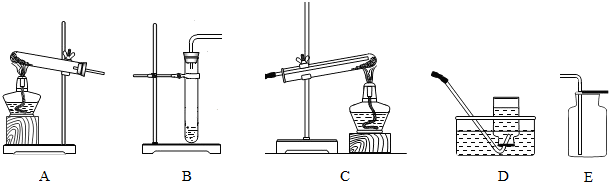
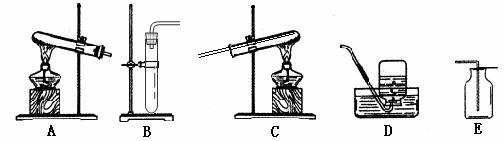
题目内容
 为了选择实验室制取二氧化碳的反应物,某实验小组取等量的碳酸盐和足量等浓度的酸,
为了选择实验室制取二氧化碳的反应物,某实验小组取等量的碳酸盐和足量等浓度的酸,
设计了以下四种反应物组合进行探究实验,结果如下图所示.

(1)根据实验结果,他们决定选择大理石与稀盐酸来制取二氧化碳,发生反应的化学方程式为________.他们不选择①和④的原因分别是________.
(2)探究结果说明,影响碳酸盐与酸反应产生二氧化碳快慢的因素有________.
解:(1)由图象可以看出碳酸钠粉末与稀盐酸反应快;块状大理石与稀硫酸反应慢,且反应一段时间即自行停止;
(2)根据图示对比四组反应物的性质和状态,得出结论.
故答案为:
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;①碳酸钠粉末与酸反应速度太快,不易收集;④生成物硫酸钙微溶,会阻止反应进一步进行.
(2)反应物种类(本身的性质)反应物的状态(接触面积)
分析:对比题意中的四种设计方案,结合图形给予的信息,可以分析得出:碳酸钠粉末与稀盐酸反应快不易收集,块状大理石与稀硫酸反应慢,在大理石粉末与稀盐酸和块状大理石与稀盐酸之间,根据反应速度快慢,我们很自然的就会选择块状大理石与稀盐酸反应制取CO2.
点评:此题主要是对于反应物的种类和状态影响了反应的速度作出了探究,并培养了学生对于科学实验的实事求是的精神.
(2)根据图示对比四组反应物的性质和状态,得出结论.
故答案为:
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;①碳酸钠粉末与酸反应速度太快,不易收集;④生成物硫酸钙微溶,会阻止反应进一步进行.
(2)反应物种类(本身的性质)反应物的状态(接触面积)
分析:对比题意中的四种设计方案,结合图形给予的信息,可以分析得出:碳酸钠粉末与稀盐酸反应快不易收集,块状大理石与稀硫酸反应慢,在大理石粉末与稀盐酸和块状大理石与稀盐酸之间,根据反应速度快慢,我们很自然的就会选择块状大理石与稀盐酸反应制取CO2.
点评:此题主要是对于反应物的种类和状态影响了反应的速度作出了探究,并培养了学生对于科学实验的实事求是的精神.

练习册系列答案
相关题目