题目内容
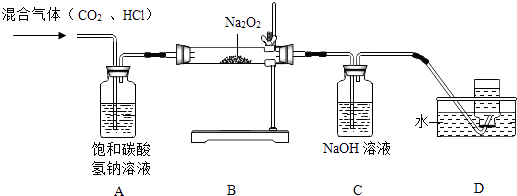
【题目】根据下列装置,结合所学化学知识回答下列问题. 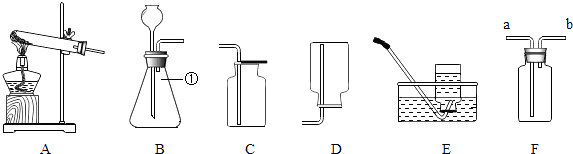
(1)写出标号仪器①的名称: .
(2)实验室选择装置A用高锰酸钾制取氧气时,你认为A装置存在的问题是 , 该反应的化学方程式是 , 选择收集装置应依据氧气、的物理性质以及不与水和空气反应的化学性质..
(3)实验室可以选择装置(填A﹣E中的字母)制取并收集CO2气体,该反应的化学方程式是 , 验满的方法是;
(4)通常情况下,SO2是一种无色、有刺激性气味的气体,密度比空气大,易溶于水且水溶液显酸性.实验室里,用亚硫酸钠固体和浓硫酸反应制取SO2 . 实验室制取SO2选择的发生装置是(填字母),若选择F装置收集SO2 , 气体应该从口(填“a”或“b”)进入,实验结束后剩余的SO2气体用吸收,吸收的目的是 .
【答案】
(1)锥形瓶
(2)试管口无棉花团;2KMnO4 ![]() K2MnO4+MnO2+O2↑;密度;溶解性
K2MnO4+MnO2+O2↑;密度;溶解性
(3)BC;CaCO3+2HCl=CaCl2+CO2↑+H2O;用燃着的木条放在瓶口,如果木条熄灭则说明瓶内已收集满二氧化碳
(4)B;a;氢氧化钠溶液;防止二氧化硫污染空气
【解析】解:(1)锥形瓶是常用的反应容器,所以答案是:锥形瓶;(2)加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;选择收集装置应依据氧气密度和溶解性;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;所以答案是:试管口没有放棉花团、密度、溶解性、2KMnO4 ![]() K2MnO4+MnO2+O2↑;(3)实验室制取CO2 , 是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;所以答案是:BC;CaCO3+2HCl=CaCl2+H2O+CO2↑;将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;(4)实验室里,用亚硫酸钠固体和浓硫酸反应制取SO2 , 因此不需要加热;若选择F装置收集SO2 , 气体应该从长管进入,因为二氧化硫的密度比空气的密度大;实验结束后剩余的SO2气体用氢氧化钠溶液吸收,吸收的目的是:防止二氧化硫污染空气;所以答案是:B;a;氢氧化钠溶液;防止二氧化硫污染空气.
K2MnO4+MnO2+O2↑;(3)实验室制取CO2 , 是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;所以答案是:BC;CaCO3+2HCl=CaCl2+H2O+CO2↑;将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;(4)实验室里,用亚硫酸钠固体和浓硫酸反应制取SO2 , 因此不需要加热;若选择F装置收集SO2 , 气体应该从长管进入,因为二氧化硫的密度比空气的密度大;实验结束后剩余的SO2气体用氢氧化钠溶液吸收,吸收的目的是:防止二氧化硫污染空气;所以答案是:B;a;氢氧化钠溶液;防止二氧化硫污染空气.
【考点精析】本题主要考查了氧气的制取装置和二氧化碳的检验和验满的相关知识点,需要掌握发生装置:固固加热型、固液不加热型;验证方法:将制得的气体通入澄清的石灰水,如能浑浊,则是二氧化碳.验满方法:用点燃的木条,放在集气瓶口,木条熄灭.证明已集满二氧化碳气体才能正确解答此题.

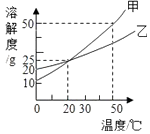
【题目】如图,一木块漂浮于X中,向X中缓缓加入(或通入)少量物质Y后最终木块上浮,则X与Y可能是(溶液的体积变化忽略不计)( )
序号 | X | Y |
① | 水 | 酒精 |
② | 氢氧化钙溶液 | 二氧化碳 |
③ | 稀硫酸 | 镁粉 |
④ | 硫酸铜溶液 | 锌粉 |

A.①②④
B.③④
C.①②③
D.②③④