��Ŀ����
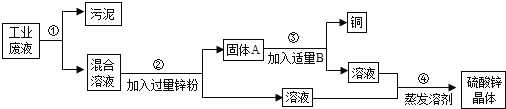
����Ŀ��ij�������ŷŵķ�Һ�к��д���������п������ͭ����ѧ��ȤС���ͬѧ������ѧ֪ʶ�����һ���������������ս���ͭ���õ�����п���壬��Ҫ������ͼ��ʾ��
��ش��������⣺
��1��������з������ʵķ�����______������������õ��IJ���������______��һ�֣���
��2������A�ijɷ���______��
��3��������з�����Ӧ�Ļ�ѧ����ʽΪ______���÷�Ӧ�Ļ���������______��
��4���������Ϊʲô����������B���ʶ����ǹ���______��
���𰸡����� �ձ���©���������� п��ͭ Zn+CuSO4=Cu+ZnSO4 �û���Ӧ ��������µ�����
��������
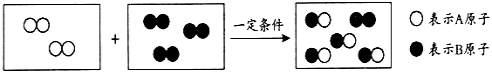
��1���������������Һ�����IJ�������Ϊ���ˣ�����������õ��IJ��������ǣ��ձ���©������������
��2����������ͼ��֪��п������ͭ��Ӧ��������п��ͭ������A�ijɷ��ǹ�����п���������ͭ��
��3���������з����ķ�Ӧ��п������ͭ��Ӧ��������п��ͭ����ѧ����ʽΪ��Zn+CuSO4�TCu+ZnSO4���÷�Ӧ����һ�ֵ�����һ�ֻ����ﷴӦ��������һ�ֵ��ʺ���һ�ֻ�����ķ�Ӧ�������û���Ӧ��
��4����������ͼ��֪���������м���������B������ϡ���ᣬ�������ܳ�ȥ���ᡣ������м���������B���ʶ����ǹ���ԭ���DZ�������µ����ʡ�

 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
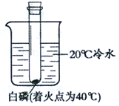
�������Ͽ�ʱͬ��ѵ��ϵ�д�����Ŀ��ij��ȤС��ͬѧ������ͼ��ʾװ�ý��С���������ͭ��Һ��Ӧ����ʵ��ʱ�����ַ�Ӧ��ʼ���Թ��г��ֺ�ɫ����ͬʱ������ɫ��ζ���塣��ȤС��ͬѧ����������̽����

ʵ��1����5����ͬ���������ͭ��Һ�зֱ������澭����ĥ��������ͬ���ȵ��������������£�
ʵ����� | �� | �� | �� | �� | �� | �� | �� |
����ͭ��ҺŨ�� | 24% | 12% | 8% | 6% | 5% | 3% | 1% |
������� | �ܿ� | �� | �Ͽ� | �� | �Ͽ� | �� | �� |
ʵ��2������������Ϊ8%������ͭ��Һ�ֱ������澭����ĥ��������ͬ���ȵ��������������£�
ʵ����� | �� | �� | �� | �� | �� |
ˮԡ�¶ȣ��棩 | 20 | 30 | 40 | 50 | 60 |
������� | �Ͽ� | �� | �ܿ� | �ܿ� | �ܿ� |
��1��ʵ��1��Ŀ����______��
��2��ʵ��2�Ľ�����______��
��3������ʵ��1��ʵ��2���Ʋ�50�� 5% ����ͭ��Һ��������Ӧ��������________��
����˼�����ۣ�
��4��ʵ��2û�н����¶�Ϊ70���ʵ�飬������_______��
��5��������IJ��룬�����е�������______��