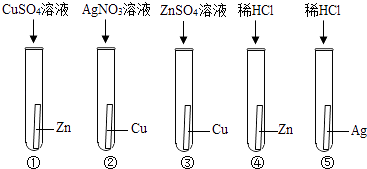
��Ŀ����
����Ŀ����ͼ��ʾ�Ȼ��ơ�����ء�����þ�������ʵ��ܽ�����ߣ���ش� 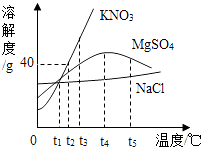
��1��t1��ʱ��������Һ����������������ͬ������������ ��
��2��t2��ʱ����40g����ط���60gˮ�У�����ܽ��������Һ������Ϊg��
��3��t3��ʱ���ܽ�������� ��
��4��t4��ʱ�������������䣬������þ������Һ���µ�t5�棬�۲쵽�������� ��
��5���Ȼ�����Һ�к���������������ʣ��ᴿ�ķ�������������ܼ�������ȴ�ȱ�����Һ������
���𰸡�
��1������ء��Ȼ���
��2��84
��3�������
��4���������
��5����ȴ�ȱ�����Һ
���������⣺��1��t1��ʱ������ء��Ȼ��Ƶ��ܽ����ȣ����Ա�����Һ����������������ͬ����������������ء��Ȼ��ƣ���2��t2��ʱ������ص��ܽ����40g�����Խ�40gKNO3����60gˮ�У�����ܽ��������Һ������Ϊ84g����3��ͨ�������ܽ�����߿�֪��t3��ʱ���ܽ������������أ���4��t4�橁t5��ʱ������þ���ܽ�����¶ȵ����߶���С������t4��ʱ�������������䣬��MgSO4������Һ���µ�t5�棬�۲쵽���������о�����������5������ص��ܽ�����¶�Ӱ��ϴ�����KNO3��Һ�к�������NaCl���ʣ��ᴿ�ķ����ǣ���ȴ�ȱ�����Һ�� �ʴ�Ϊ����1������ء��Ȼ��ƣ���2��84����3������أ���4���о�����������5����ȴ�ȱ�����Һ��
���ݹ�����ܽ�����߿��ԣ��ٲ��ij������һ���¶��µ��ܽ�ȣ��Ӷ�ȷ�����ʵ��ܽ��ԣ��ڱȽϲ�ͬ������ͬһ�¶��µ��ܽ�ȴ�С���Ӷ��жϱ�����Һ�����ʵ����������Ĵ�С�����ж����ʵ��ܽ�����¶ȱ仯�ı仯������Ӷ��ж�ͨ�����½ᾧ���������ᾧ�ķ����ﵽ�ᴿ���ʵ�Ŀ�ģ�

 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д�