题目内容
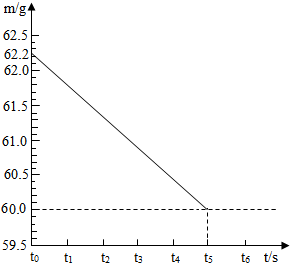 将碳酸钠和硫酸钠的固体混合物6g,放入烧杯中,再加入一定量的稀硫酸,在一定时间内恰好完全反应,无固体剩余,所得溶液溶质质量分数为19.5%,反应的时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示.
将碳酸钠和硫酸钠的固体混合物6g,放入烧杯中,再加入一定量的稀硫酸,在一定时间内恰好完全反应,无固体剩余,所得溶液溶质质量分数为19.5%,反应的时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示.
(1)生成气体的质量为______.
(2)求6g固体混合物中碳酸钠的质量.
(3)根据所给条件能计算出所加稀硫酸的溶质质质量分数吗?______(填“能”或“不能”),如能,需要分别计算纯净物______的质量;如不能,你认为只要知道______的值就可以计算了(如果“能”,此空不填).
解:(1)根据烧杯中所盛物质的质量曲线,反应放出二氧化碳的质量=62.2g-60.0g=2.2g;
故答案为:2.2g;
(2)设原混合物中碳酸钠的质量为x.
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 2.2g
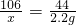
x=5.3g
答:6g固体混合物中碳酸钠的质量为5.3g;
(3)设参加反应硫酸的质量为a,反应生成硫酸钠的质量为b
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
98 142 44
a b 2.2g
 =
=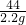 a=4.9g
a=4.9g
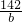 =
=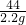 b=7.1g
b=7.1g
则反应后所得硫酸钠溶液的质量=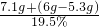 =40g
=40g
所加稀硫酸溶液的质量=40g+2.2g-6g=36.2g
所加稀硫酸的溶质质质量分数=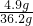 ×100%≈13.5%
×100%≈13.5%
故答案为:能;H2SO4和Na2SO4.
分析:向碳酸钠和硫酸钠的混合物中加入稀硫酸,碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,由于放出气体二氧化碳而使烧杯内所盛物质的总质量减小,质量减小的值即反应放出的二氧化碳的质量;
根据反应的化学方程式,由放出二氧化碳的质量可计算混合物中碳酸钠的质量;
要计算所加稀硫酸的溶质质量分数,需要知道所加稀硫酸的质量和稀硫酸中硫酸的质量,而硫酸的质量可由反应放出二氧化碳气体的质量求得;要求得所加稀硫酸的质量,可根据质量守恒定律,所加稀硫酸的质量=反应后所得溶液质量+放出气体二氧化碳的质量-固体混合物的质量.
点评:根据质量守恒定律,反应后所得溶液的质量=所加稀硫酸的质量+固体混合物的质量-放出气体的质量.
故答案为:2.2g;
(2)设原混合物中碳酸钠的质量为x.
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 2.2g
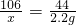
x=5.3g
答:6g固体混合物中碳酸钠的质量为5.3g;
(3)设参加反应硫酸的质量为a,反应生成硫酸钠的质量为b
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
98 142 44
a b 2.2g
 =
=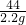 a=4.9g
a=4.9g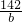 =
=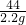 b=7.1g
b=7.1g则反应后所得硫酸钠溶液的质量=
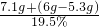 =40g
=40g所加稀硫酸溶液的质量=40g+2.2g-6g=36.2g
所加稀硫酸的溶质质质量分数=
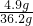 ×100%≈13.5%
×100%≈13.5%故答案为:能;H2SO4和Na2SO4.
分析:向碳酸钠和硫酸钠的混合物中加入稀硫酸,碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,由于放出气体二氧化碳而使烧杯内所盛物质的总质量减小,质量减小的值即反应放出的二氧化碳的质量;
根据反应的化学方程式,由放出二氧化碳的质量可计算混合物中碳酸钠的质量;
要计算所加稀硫酸的溶质质量分数,需要知道所加稀硫酸的质量和稀硫酸中硫酸的质量,而硫酸的质量可由反应放出二氧化碳气体的质量求得;要求得所加稀硫酸的质量,可根据质量守恒定律,所加稀硫酸的质量=反应后所得溶液质量+放出气体二氧化碳的质量-固体混合物的质量.
点评:根据质量守恒定律,反应后所得溶液的质量=所加稀硫酸的质量+固体混合物的质量-放出气体的质量.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目



