题目内容
【题目】如图是元素周期表的一部分.原子序数为12的元素名称为;等质量的钠和铝,所含原子数较多的是;已知SiO2与CO2具有相似的化学性质,则二氧化硅与氢氧化钠溶液反应的化学方程式为 . 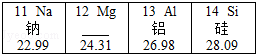
【答案】镁;钠(或Na);2NaOH+SO2=Na2SiO3+H2O
【解析】解:12号元素是镁元素,等质量的金属中,相对原子质量越小的所含的原子个数越多,钠的相对原子质量为23,铝的相对原子质量为27,则等质量的钠和铝,所含原子数较多的是钠;二氧化硅与氢氧化钠反应生成硅酸钠和水,化学方程式为SiO2+2NaOH═Na2SiO3+H2O. 所以答案是:镁;钠(或Na);2NaOH+SO2=Na2SiO3+H2O.
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目